
钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
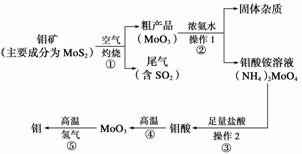
(1)写出反应①的化学方程式:___________________________________________。
(2)反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂________________________________________________________________________。
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有________________________________________________________________________。
(4)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为________。
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4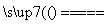 2CO+2H2,CH4+H2O
2CO+2H2,CH4+H2O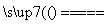 CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________(铜的相对原子质量为96)。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________(铜的相对原子质量为96)。
解析 (1)二硫化钼与氧气在高温下反应生成三氧化钼和二氧化硫。(2)二氧化硫可收集再利用,制备硫酸和盐类等。(3)操作1和操作2都是分离固体与液体混合物,都是过滤
操作。(4)钼酸是二元酸,可直接写出钼酸钠。(5)根据反应方程式知,1 mol甲烷完全反应生成4 mol还原性气体,而:3CO+MoO3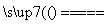 Mo+3CO2,3H2+MoO3
Mo+3CO2,3H2+MoO3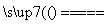 Mo+3H2O,3 mol还原性气体理论上生成1 mol钼。n(CH4)=
Mo+3H2O,3 mol还原性气体理论上生成1 mol钼。n(CH4)=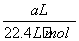 ×80%,n(H2+CO)=
×80%,n(H2+CO)=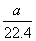 ×80%×90%×4 mol=
×80%×90%×4 mol=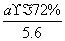 mol,n(Mo)=
mol,n(Mo)=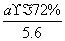 ×
×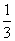 mol=
mol=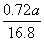 mol,m(Mo)=
mol,m(Mo)=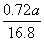 mol×96 g·mol-1≈4.11a g。
mol×96 g·mol-1≈4.11a g。
答案 (1)2MoS2+7O2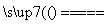 2MoO3+4SO2
2MoO3+4SO2
(2)H2SO4、Na2SO3[或Na2SO4、(NH4)2SO4等]
(3)烧杯、漏斗、玻璃棒
(4)Na2MoO4
(5)4.11a g


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
对盆栽鲜花施用了S-诱抗素制剂可保证鲜花盛开。S-诱抗素的分子结构如下图,
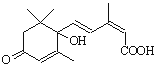
下列关于该物质的说法正确的是 ( )
A.其分子式为C15H22O4
B.1 mol该物质与NaOH溶液反应,最多消耗2 molNaOH
C.既能发生加聚反应,又能发生缩聚反应
D.既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关有机物结构的叙述不正确的是
A.一氟一氯甲烷只有一种结构,可以证明甲烷是正四面体结构
B.乙烯和甲苯分子中所有原子都在同一个平面上
C.邻二甲苯没有同分异构体表明苯的凯库勒结构式存在局限,不准确
D.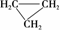 和CH3—CH==CH2互为同分异构体
和CH3—CH==CH2互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
把2.5 mol A和2.5 mol B混合盛入容积为2 L的密闭容器里,发生如下反应:3A(g) +B(g)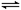 x C(g) + 2D(g) ,经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中错误的是
x C(g) + 2D(g) ,经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中错误的是
A.达到平衡状态时A的转化率为50% B.x=4
C.达到平衡状态时容器内气体的压强与起始时压强比为6:5
D.5s内B的反应速率v(B)=0.05 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
KNO3是重要的化工产品,下面是一种已获得专利的KNO3制备方法的主要步骤:
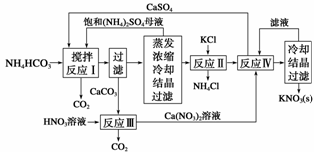
(1)反应Ⅰ中,CaSO4与NH4HCO3的物质的量之比为1∶2,该反应的化学方程式为_____
___________________________________________________________________。
(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是___________________________
___________________________________ _____________________________________;
_____________________________________;
从反应Ⅳ所得混合物中分离出CaSO4的方法是趁热过滤,趁热过滤的目的是________________________________________________________________________。
(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于 水,________________________________________________________________________。
水,________________________________________________________________________。
(4)整个流程中,可循环利用的物质除(NH4)2SO4外,还有________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.2.4g Mg与足量的盐酸反应失去的电子数为0.2NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.标准状况下,22.4L H2O含有的分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com