
下列说法正确的是
A.HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高
B.熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物
C.NCl3分子中所有的原子均为8电子稳定结构
D.NaHSO4晶体中阴、阳离子的个数比是1∶2且熔化时破坏的是离子键和 共价键
共价键
科目:高中化学 来源:2016-2017学年江西省高一上第二次考试化学卷(解析版) 题型:实验题
现有一定量含 有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度,实验时将样品放置于D中。(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度,实验时将样品放置于D中。(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
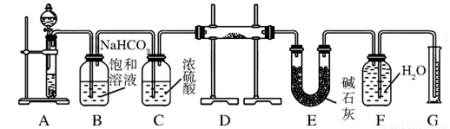
回答下列问题:
(1)装置A中液体试剂选用 。
(2)装置B的作用是 。装置C的作用是 。
装置E中碱石灰的作用是 。
(3)装置D中发生反应的化学方程式是 、  。
。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上月考三化学卷(解析版) 题型:填空题
某化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
浓度 时间 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60[ |
4 | 820℃ | 1.0 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
根据上述实验数据,完成下列填空:
(1)在实验1中,反应在10至20min时间内,反应物A的平均速率为 mol/(L·min)。
(2)在实验2中,A的初始浓度C2= mol/L,反应经20minA的浓度就不再发生变化,进而可推测实验2中隐含的条件是 。
(3)在实验3中,A的初始浓度C3 1.0mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是____________反应(选填“吸热”、“放热”)。理由是_________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上月考三化学卷(解析版) 题型:选择题
己烯雌酚是一种激素类药物,结构如图所示,下列有关叙述中正确的是

A.该有机物属于芳香烃
B.该物质不能使酸性高锰酸钾溶液褪色
C.该分子对称性好,所以没有顺反异构
D.该有机物分子中,最多可能有18个碳原子共平面
查看答案和解析>>
科目:高中化学 来源:2017届湖南师大附中高三上月考四化学试卷(解析版) 题型:填空题
(1)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 _。
(2)用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O Cu2O+H2↑,如图1 所示。该电解池的阳极反应式为 。
Cu2O+H2↑,如图1 所示。该电解池的阳极反应式为 。

(3)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定某溶液中的含钒量,反应的离子方程式为:2VO +H2C2O4+
+H2C2O4+ 2H+===2VO2++2CO2↑+2H2O,取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L(保留一位小数)。
2H+===2VO2++2CO2↑+2H2O,取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源:2017届湖南师大附中高三上月考四化学试卷(解析版) 题型:选择题
可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
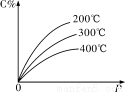
A.达到平衡后,若升高温度,平衡右移
B.达到平衡后,加入催化剂C%增大
C.化学方程式中“n>e+f”
D.达到平衡后,增加A的量有利于平衡向右移动
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江牡丹江第一高级中学高三12月月考化学卷(解析版) 题型:填空题
某同学组装了如图所示的电化学装置,电解质溶液均为足量,回答下列问题

(1)电极名称:Cu电极 极,甲池发生的电极总反应离子方程式
(2)若用U形铜丝代替“盐桥”,工作一段时间后,甲池中Ag电极质量增加5.4g时,乙池电解质溶液为饱和食盐水。乙池中电极总反应化学方程式 ;
U形铜丝反应前后质量变化 (填写增大、减小、不变);若要恢复乙池电解质溶液浓度、体积,需向溶液中加 (填物质名称)物质的量为 mol
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江牡丹江第一高级中学高三12月月考化学卷(解析版) 题型:选择题
下列有关物质的分类或归类正确的是
①混合物:波尔多液、盐酸、水银
②化合物:氯化钾、甲烷、HD
③电解质:明矾、胆矾、硫酸钡
④非电解质:酒精、CO2、Cl2
⑤同位素:12C、13C、14C
A.③④ B.③⑤ C.②③⑤ D.②④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上期中化学试卷(解析版) 题型:选择题
己知Co2O3在酸性溶液中易被还原成Co2+且Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列叙述中,正确的是
A.Cl2通入FeI2溶液中,可存在反应 3Cl2+6FeI2=2FeCl3+4FeI3
B.每1mol Co2O3在酸性溶液中被氧化生成Co2+时转移2 mol e-
C.FeCl3溶液能使淀粉-KI试纸变蓝
D.I2具有较强的氧化性,可以将Co2+氧化成Co2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com