
【题目】短周期主族元素 X、Y、Z、Q、R 的原子序数依次增大,X 的简单阴离子与锂离子具有相同的电子层结构,Y原子最外层电子数等于内层电子数的2倍,Q 的单质与稀硫酸剧烈反应生成 X 的单质。向100mLX2R的水溶液中缓缓通入RZ2 气体,溶液pH与RZ2 体积关系如下图。下列说法正确的是( )
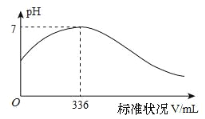
A. X2R 溶液的浓度为0.03mol·L-1
B. 最简单气态氢化物的稳定性:Y>Z>R
C. 工业上通常采用电解法冶炼Q的单质
D. RZ2 通入 BaCl2、Ba(NO3)2 溶液中,均无明显现象
【答案】C
【解析】
短周期主族元素 X、Y、Z、Q、R 的原子序数依次增大,X 的简单阴离子与锂离子具有相同的电子层结构,说明X为氢元素;Y原子最外层电子数等于内层电子数的2倍,为碳元素;Q 的单质与稀硫酸剧烈反应生成 X 的单质,为活泼金属,可能为钠、镁、铝中的一种。向100mLX2R的水溶液中缓缓通入RZ2 气体,根据溶液的pH变化分析,应为硫化氢和二氧化硫的反应,即R为硫,Z为氧。
A. 2H2S+SO2=2H2O+3S,根据图像分析,当二氧化硫的体积为336mL时,溶液的pH为7,说明硫化氢的物质的量为0.3mol,其浓度为0.3/0.1=3mol/L,故错误;
B. 非金属性越强,其最简单气态氢化物的稳定性越强,故稳定性顺序为: Z>R> Y,故错误;
C. Q为活泼金属钠、镁、铝中的一种,工业上通常采用电解法冶炼Q的单质,故正确;
D. 二氧化硫通入Ba(NO3)2 溶液中会产生硫酸钡沉淀,故错误。
故选C。


科目:高中化学 来源: 题型:
【题目】(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器内,进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)。
CO2(g)+H2(g)。
得到如下两组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要的时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
①实验1中以v(CO2)表示的反应速率为___。
②该反应的逆反应为___(填“吸”或“放”)热反应。
(2)在一容积为2L的密闭容器内加入2mol的CO和6mol的H2,在一定条件下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0该反应的逆反应速率与时间的关系如图所示:
CH3OH(g) △H<0该反应的逆反应速率与时间的关系如图所示:
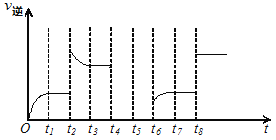
①由图可知反应在t1、t3、t7时都达到平衡,而在t2、t8时都改变了条件,试从以下措施中选出适宜的改变条件:t2___、t8___。(此处两空均填下列选项字母序号)
a.增加CO的物质的量 b.加催化剂 c.升高温度 d.压缩容器体积 e.将CH3OH气体液化 f.充入氦气
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆应速率与时间的关系曲线___。
(3)已知反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)在100kPa下△H=-113.0kJ/mol,△S=-145.3J·mol-1·K-1。理论上,该反应在温度___(填“高于”或“低于”)___时均可自发进行。
N2(g)+2CO2(g)在100kPa下△H=-113.0kJ/mol,△S=-145.3J·mol-1·K-1。理论上,该反应在温度___(填“高于”或“低于”)___时均可自发进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为_________。
(2)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)> I1(Na),原因是_________。I1(Be)> I1(B)> I1(Li),原因是________。
(3)磷酸根离子的空间构型为_______,其中P的价层电子对数为_______、杂化轨道类型为_______。
(4)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有____个。
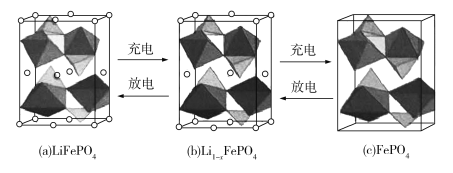
电池充电时,LiFeO4脱出部分Li+,形成Li1xFePO4,结构示意图如(b)所示,则x=_______,n(Fe2+ )∶n(Fe3+)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NH3是工业生产中的常用气体,研究其在工业上的反应过程对提高生产效率尤为重要。
I.工业上用CO和H2做原料可以合成甲醇,作为液体燃料。已知:
① 2H2(g)+CO(g) +![]() O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
② 2CH3OH(l)+3O2(g) = 4H2O(g)+2CO2(g) ΔH2 = -1452kJ/mol
(1)请写出用CO(g)和H2(g)合成1mol液态甲醇的热化学反应方程式:______________。
(2)一定温度下,在容积为2L的恒容容器中加入3mol H2和2mol CO,当反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的
CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的![]() ,计算得该温度下反应的平衡常数K=____________。保持恒温恒容,向上述达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡移动方向为________移动(填“正向”、“逆向”或“不”)。
,计算得该温度下反应的平衡常数K=____________。保持恒温恒容,向上述达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡移动方向为________移动(填“正向”、“逆向”或“不”)。
II.对于氨的合成反应 N2(g)+3H2(g)![]() 2NH3(g) △H<0,在密闭容器内充入0.1mol/L N2和0.3 mol/L H2。反应中NH3的物质的量浓度的变化情况如下图,试回答问题:
2NH3(g) △H<0,在密闭容器内充入0.1mol/L N2和0.3 mol/L H2。反应中NH3的物质的量浓度的变化情况如下图,试回答问题:
(3)恒容条件下,从开始反应到建立起平衡状态,v(N2)=_________;反应达到平衡后,第5分
钟末只改变反应温度,保持其它条件不变,则改变条件后NH3的物质的量浓度不可能为_____。
A. 0.20 mol/L B. 0.12 mol/L C. 0.10 mol/L D. 0.08 mol/L
(4)在第5分钟时将容器的体积缩小一半,反应在第8分钟时达到新的平衡,此时NH3的浓度约为0.30 mol/L。请在上图中画出第5分钟之后的NH3浓度的变化曲线______。
(5)其它条件不变,若只把容器改为恒压容器,加入0.2 molN2和0.6 molH2,达到平衡时,NH3的体积分数为m%。若向容器中继续加入0.2 molN2和0.6 molH2,,在同样的温度下达到平衡时,NH3的体积分数为n%,则m和n的关系正确的是______。
A.m>n B.m<n C.m=n D.无法比较%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素E是一种人体必需的脂溶性维生素,现已广泛应用于医药、营养品、化妆品等。天然的维生素E由多种生育酚组成,其中α-生育酚(化合物E)含量最高,生理活性也最高。下面是化合物E的一种合成路线,其中部分反应略去。
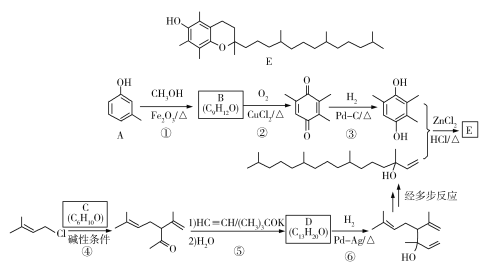
已知以下信息:a) 
b) 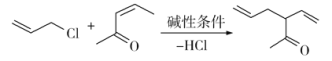
c) 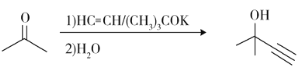
回答下列问题:
(1)A的化学名称为_____________。
(2)B的结构简式为______________。
(3)反应物C含有三个甲基,其结构简式为______________。
(4)反应⑤的反应类型为______________。
(5)反应⑥的化学方程式为______________。
(6)化合物C的同分异构体中能同时满足以下三个条件的有_________个(不考虑立体异构体,填标号)。
(ⅰ)含有两个甲基;(ⅱ)含有酮羰基(但不含C=C=O);(ⅲ)不含有环状结构。
(a)4 (b)6 (c)8 (d)10
其中,含有手性碳(注:连有四个不同的原子或基团的碳)的化合物的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.质谱、红外光谱都能够快速、精确地测定有机物的相对分子质量
B.核磁共振氢谱中,CH3COOH、CH3OH都可给出两种峰信号
C. 的名称为2-甲基-3-丁醇
的名称为2-甲基-3-丁醇
D.乙二醇和丙三醇互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物瑞德西韦(Remdesivir)对新冠病毒有明显抑制作用,化合物 M是合成瑞德西韦的中间体,下列关于M的说法错误的是
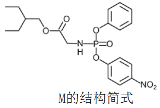
A.核磁共振氢谱共有11个吸收峰
B.分子中含有3种含氧官能团
C.分子中N原子一个是sp2杂化,一个是sp3杂化
D.1mol该物质与足量NaOH溶液反应时消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是 ( )

M
A. M与A均能使酸性高锰酸钾溶液和溴水褪色
B. B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C. 1 mol M与热的烧碱溶液反应,可消耗2n mol NaOH
D. A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.7.8g苯含σ键的数目为0.6NA
B.将Cl2通入FeBr2溶液中,有1molBr2生成时,转移的电子数为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH![]() 的数目为NA
的数目为NA
D.有铁粉参加的反应若生成3molFe2+,则转移电子数一定为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com