
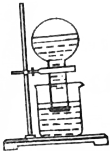
 甲同学按如图所示装置做新制氯水受日光照射分解放出O2的验证实验,结果现象不明显.
甲同学按如图所示装置做新制氯水受日光照射分解放出O2的验证实验,结果现象不明显.分析 (1)HClO不稳定,光照分解;
(2)次氯酸的浓度高低是决定本实验的现象是否明显的关键.
解答 解:(1)氯水受日光照射的化学方程式为2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,故答案为:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;
(2)将新制氯水先在暗处存放3~4天,促使氯水中存在的平衡H20+Cl2?HClO+HCl向右移,显然可提高次氯酸的浓度,光照时发生2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,效果十分明显,
答:平衡H20+Cl2?HClO+HCl向右移,显然可提高次氯酸的浓度.
点评 本题考查物质的性质,为高频考点,把握HClO的性质及化学平衡的移动为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO-3+Ba2++2OH-═BaCO3↓+2H2O+CO32- | |
| B. | Fe(NO3)3溶液中加入过量的HI溶液;2Fe3++2I-═2Fe2++I2 | |
| C. | Na2S203溶液中加入稀硫酸:S2O32-+2H+═SO2+S↓+H2O | |
| D. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+═Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 下列生活用品主要由有机合成材料制成:羊毛衫、腈纶运动衣、涤纶连衣裙、纯棉T恤 | |
| B. | 不锈钢制作就是在普通钢中添加铬、镍等元素改变了钢铁内部结构,所以不锈钢是化合物 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 建筑业使用大量的沙,常使用内陆河的河沙及海洋的海沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl(澄清石灰水) | B. | NO2(H2O) | C. | SO2(H2O2溶液) | D. | Cl2(NaOH溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L氮气所含原子数目大于2NA | |
| B. | 1 mol Na2O2跟H2O反应转移的电子数目为2NA | |
| C. | 标准状态下,22.4L三氧化硫所含分子数目大于NA | |
| D. | 1 mol甲烷的质量与0.5 mol O2的质量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)已知下热化学方程式:
(1)已知下热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | MgCl2 | B. | FeSO4 | C. | Na2SO3 | D. | ZnSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色固体中既有KI,又有BaCl2 | B. | 白色固体中既有NaBr,又有BaCl2 | ||
| C. | 白色固体中可能有KI | D. | 白色固体中可能没有NaBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | T(℃) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表 面积(m2•g-1) |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 1.2×10-3 | 124 | ||
| Ⅲ | 350 | 82 |
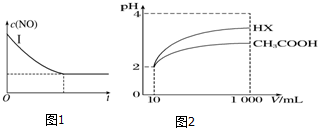
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平 衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com