
【题目】微型化学实验可以有效实现化学实验绿色化的要求。如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好。根据上述描述涉及到的元素,回答问题:

(1)KMnO4中Mn元素的化合价为:_______________,Fe在周期表中的位置是:_____________________。
(2)第三周期原子半径最小的原子共有______ 种不同能量的电子;长周期主族元素形成化合物的电子式为:__________________。
(3)结合已学知识分析a、c处的可能出现的现象:a:_____________________________;c:_________________________________;b处可能发生反应的离子方程式:___________________________________________________________
(4)已知溶液中,还原性为HSO3>I-,氧化性为IO3>I2>SO42.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示:

①a点处的还原产物是:____________(填离子符号); b点→c点反应的离子方程式是:_________________________________________
②当溶液中的I-为0.5mol时,加入的KIO3可能是:____________________ mol。
【答案】+7 第四周期Ⅷ族 5 ![]() 溶液变为蓝色 红色褪去(或红色变浅) 2Fe2++Cl2→2Fe3+ +2Cl-、Fe3+ +3SCN-→Fe(SCN)3 I- IO3-+6H++5I-→3H2O+3I2 0.5或1.1
溶液变为蓝色 红色褪去(或红色变浅) 2Fe2++Cl2→2Fe3+ +2Cl-、Fe3+ +3SCN-→Fe(SCN)3 I- IO3-+6H++5I-→3H2O+3I2 0.5或1.1
【解析】
化合物中各元素化合价的代数和为零;Fe位于元素周期表的第四周期Ⅷ族;氯气能将碘离子氧化为碘单质,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,据此分析实验现象;氯气能将亚铁离子氧化为Fe3+,Fe3+与硫氰化钾反应生成络合物硫氰化铁;还原性HSO3>I-,首先发生反应:![]() ,HSO3反应完毕,继续加入KIO3,由于氧化性IO3->I2,再发生反应:
,HSO3反应完毕,继续加入KIO3,由于氧化性IO3->I2,再发生反应:![]() ,结合a点没有生成I2分析;当溶液中的I-为0.5mol时,有两种情况:一是只发生反应:
,结合a点没有生成I2分析;当溶液中的I-为0.5mol时,有两种情况:一是只发生反应:![]() ;二是HSO3反应完毕后,还发生反应:
;二是HSO3反应完毕后,还发生反应:![]() ,据此分析即可。
,据此分析即可。
(1)根据化学式书写原则,KMnO4中K是+1价,O是-2价,化合物中各元素化合价的代数和为零,所以Mn元素的化合价为+7;在周期表中,Fe位于第四周期Ⅷ族;
(2)第三周期原子半径最小的原子是氯离子,有5个能级,有5种不同能量的电子;长周期主族元素形成化合物是离子化合物,以碘化钾为例,电子式为:![]() ;
;
(3)高锰酸钾遇到浓盐酸会立即产生氯气,氯气能将碘离子氧化为碘单质,淀粉遇碘单质显示蓝色,故a处出现的现象为:溶液变为蓝色;氯气还能和强碱氢氧化钠之间反应生成氯化钠、次氯酸钠和水,次氯酸钠水解显示弱碱性,故c处出现的现象为:红色变浅或褪去;
氯气能将亚铁离子氧化为Fe3+:![]() ,Fe3+与硫氰化钾反应生成络合物硫氰化铁:
,Fe3+与硫氰化钾反应生成络合物硫氰化铁:![]() ;
;
(4)①还原性HSO3>I-,首先发生反应:![]() ,HSO3反应完毕,继续加入KIO3,由于氧化性IO3->I2,再发生反应:
,HSO3反应完毕,继续加入KIO3,由于氧化性IO3->I2,再发生反应:![]() ;由图可知,a点没有生成I2,故发生反应:
;由图可知,a点没有生成I2,故发生反应:![]() ,还原产物是I-;b点到c点发生反应的离子方程式为:
,还原产物是I-;b点到c点发生反应的离子方程式为:![]() ;
;
②当溶液中的I-为0.5mol时,有两种情况:一是只发生反应:![]() ,生成I-为0.5mol,根据碘元素守恒n(KIO3)=n(I-)=0.5mol;二是HSO3反应完毕后,还发生反应:
,生成I-为0.5mol,根据碘元素守恒n(KIO3)=n(I-)=0.5mol;二是HSO3反应完毕后,还发生反应:![]() ,剩余I-为0.5mol,3molNaHSO3消耗1molKIO3、生成1molI-,故反应
,剩余I-为0.5mol,3molNaHSO3消耗1molKIO3、生成1molI-,故反应![]() 中消耗的I-为1mol-0.5mol=0.5mol,消耗KIO3的物质的量=0.5mol×15=0.1mol,故共加入的KIO3的物质的量=1mol+0.1mol=1.1mol。
中消耗的I-为1mol-0.5mol=0.5mol,消耗KIO3的物质的量=0.5mol×15=0.1mol,故共加入的KIO3的物质的量=1mol+0.1mol=1.1mol。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】1-溴丁烷(密度1.2758 g/mL)是重要的有机合成中间体及有机溶剂,可以在实验室里用溴化钠、浓硫酸和1-丁醇为原料,经过如图六步制得。
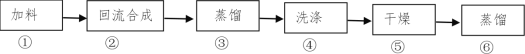
完成下列填空:
(1)通过步骤②获得粗产品,反应的化学方程式是___。此时产品往往呈红棕色,原因是____。实验室里有下列常用试剂,请根据实验需要为与步骤④相关的(2)(3)小题选择试剂,并用试剂编号填空:
a.NaOH溶液 b.NaHCO3溶液 c.NaHSO3 溶液 d.NaBr溶液
(2)产品的红棕色可用___除去(填写试剂编号),相应的离子方程式为___。
(3)选用浓硫酸洗去未反应的1-丁醇和有机副产物,然后除酸。最适宜的除酸试剂是__(填写试剂编号)。
(4)用浓硫酸(密度1.84g/mL)洗涤时,采用___(填写仪器名称)分离出___(填写“上”或“下”)层产物。
(5)检验产物中含有溴元素的实验方法是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下的溶液,叙述正确的是( )
A.某氨水溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a<b
B.若1mL pH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
C.在滴有酚酞溶液的氨水里,加入盐酸至恰好呈无色,则此时溶液的pH=7
D.1.0×10-6mol/L盐酸的pH=6,1.0×10-8mol/L盐酸的pH=8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应,在t1时达到平衡:A(g)+ B(g)![]() xC(g)+D(s)。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。有关说法正确的是
xC(g)+D(s)。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。有关说法正确的是

A.反应方程式中x=2
B.t2时刻改变的条件是使用催化剂
C.t3时刻改变的条件是移去少量D
D.t1~t3间该反应的平衡常数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想合成具有以下结构的烃分子。
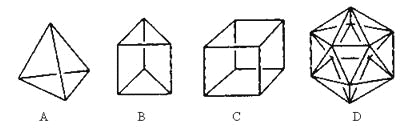
(1)结构D显然是不可能合成的,原因是________________________________;
(2)在结构A的每两个碳原子之间插入一个CH2原子团,可以形成金刚烷的结构,写出金刚烷的分子式___________;
(3)B的一种同分异构体是最简单的芳香烃,能证明该芳香烃中的化学键不是单双键交替排列的事实是______
a.它的对位二元取代物只有一种 b.它的邻位二元取代物只有一种
c.分子中所有碳碳键的键长均相等 d.能发生取代反应和加成反应
(4)下列有关烃的说法正确的是_______
a.不符合通式CnH2n+2的烃都一定含不饱和键;
b.烃分子中H原子个数不一定都比C原子个数多;
c.若知道了某烃的C、H原子个数比,只能得出该烃的最简式,不可能得出分子式;
d.烃分子中H%最高的是甲烷。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一Na2SO3固体因部分被氧化而变质。为测定样品纯度,甲、乙两位同学分别设计了如下实验方案:
(甲同学)称取m g样品溶于水,加入过量的BaCl2溶液。过滤,向沉淀中加入过量盐酸,再过滤,将残留固体洗涤后进行烘干,冷却后称得质量为m1 g。
(1)BaCl2溶液必须过量的原因是___________________________________________。在滤液中滴加____________溶液,若没有白色沉淀生成,则证明BaCl2溶液不足,还需继续在滤液中加入BaCl2溶液后进行过滤。洗涤残留固体的方法是__________________________________________________;在洗出液中滴加_______________溶液,可以判断残留固体是否洗涤干净。
(2)判断残留固体质量m1 g能够作为实验测定值代入计算式,推算样品纯度,必须补充的实验操作是_________________________________________________________。
(乙同学)称取m g样品溶于水,配成溶液,用滴定管取V mL于锥形瓶中,用浓度为c mol/L的标准酸性高锰酸钾溶液滴定至终点。反应关系为:SO32- + MnO4- SO42- + Mn2+ (未配平)
(3)配制样品溶液时,不一定需要的实验仪器是__________(选填答案编号)。
a.容量瓶 b.玻璃棒 c.滴定管 d.烧杯
(4)滴定终点的判断依据是___________________________________________________。
(5)上述滴定中,滴定管在注入酸性高锰酸钾溶液之前,先用蒸馏水洗净,再用__________________________________________。滴定管液面变化如图所示,从图Ⅰ图Ⅱ显示消耗的高锰酸钾溶液体积为__________________。
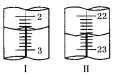
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某大理石(含Fe2O3)转化为氯化钙水合物储热材料和高纯度的碳酸钙,无论从经济效益还是资源综合利用都具有重要意义。其工艺流程示意图如下。
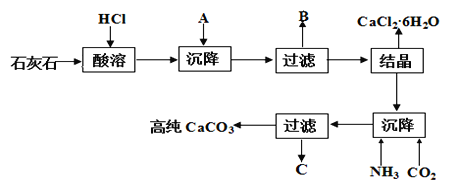
完成下列填空:
(1)上述流程中A是_________(填化学式,下同)、写出B中的成分___________。
(2)C可以作化肥,写出检验C中含有NH4+的方法:________。
(3)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是_____。
a 无毒
b 能导电
c 易溶于水
d 熔点较低(29℃熔化)
![]() CaCl2·6H2O
CaCl2·6H2O
(4)经过热重分析测得:CaCl2·6H2O在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示。则第一个相对稳定的物质的化学式是______。
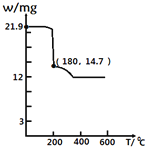
a CaCl2·4H2O
b CaCl2·2H2O
c CaCl2·H2O
d CaCl2
(5)工业还可以利用氨碱法的母液生产氯化钙。根据如图溶解度曲线,设计从含CaCl241%的饱和食盐水中,获得氯化钙水合物的流程______。
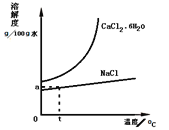
(流程示意:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M的名称是乙烯雌酚,它是一种激素类药物,结构简式如下。下列叙述不正确的是
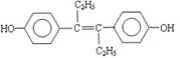
A.M属于芳香族化合物
B.M可与NaOH溶液或NaHCO3溶液发生反应
C.1molM最多能与7molH2发生加成反应
D.1molM与饱和溴水混合,最多消耗5molBr2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com