
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
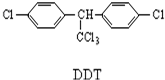
| A. | 它属于芳香烃 | B. | 分子式为C14H8Cl5 | ||
| C. | 1mol该物质能与6mol H2加成 | D. | 分子中最多可能有28个原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 收集氯气用排饱和食盐水的方法 | |
| B. | 加催化剂,使N2和H2在一定的条件下转化为NH3 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | 加压条件下有利于SO2和O2反应生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1453.28kJ•mol-1 | |
| D. | 完全燃烧16g甲醇,生成一氧化碳和水时放出的热量为221.82 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子数是次外层电子数的2倍 |
| X | L层有三个未成对电子 |
| Y | L层p电子数比s电子数多两个 |
| Z | 元素的最高正价为+7价 |
| A. | Z离子的结构示意图为: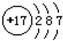 | B. | 分子TY2的键角为180° | ||
| C. | T元素在周期表中的表示为: | D. | XZ3为非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com