
将a g二氧化锰粉末加入 c L b mol·L-1的浓盐酸中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )。
A.可以收集到氯气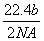 L
L
B.反应后溶液中的Cl-数目为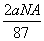
C.NA可表示为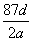
D.反应后溶液中的H+数目为bc-2d
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某化合物有碳、氢、氧三种元素组成,其红外光谱图有C﹣H键、O﹣H键、C﹣O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式是( )
|
| A. | CH3CH2OCH3 | B. | CH3CH2CH(OH)CH3 |
|
| C. | CH3CH2CH2OH | D. | CH3CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:
柠橡稀是一种食用香料,其结构为; 有关柠檬烯的分析正确的是()
有关柠檬烯的分析正确的是()
A. 柠檬烯的一氯代物有9种
B. 柠檬烯和丁基苯( )互为同分异构体
)互为同分异构体
C. 柠檬烯的分子中所有的碳原子可能在同一个平面上
D. 一定条件下,柠檬烯可以发生加成、取代、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在下图点滴板上进行四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是 ( )。
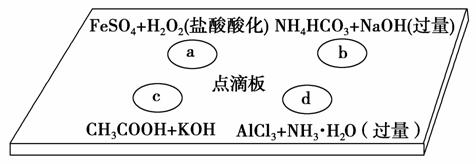
A.a反应:Fe2++2H++H2O2===Fe3++2H2O
B.b反应:HCO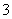 +OH-===CO
+OH-===CO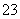 +H2O
+H2O
C.c反应:H++OH-===H2O
D.d反应:Al3++3NH3·H2O===Al(OH)3↓+3NH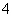
查看答案和解析>>
科目:高中化学 来源: 题型:
离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有________(填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
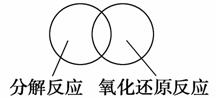
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。
(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-===H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
(4)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“Ba2++SO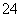 ===BaSO4↓”来表示,请写出有关反应的化学方程式(3个):
===BaSO4↓”来表示,请写出有关反应的化学方程式(3个):
①_______________________________________________________________;
②_______________________________________________________________;
③_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是 ( )。
A.由2H和18O组成的水11 g,所含的中子数为4NA
B.标准状况下11.2 L乙烷和乙烯的混合气体中含有C原子数为NA
C.在0.1 mol·L-1的醋酸溶液中,所含H+的个数小于0.1NA
D.室温下H2O2分解得到16 g O2,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
有关合金的性质叙述不正确的是 ( )。
A.合金的熔点比它的各成分金属的熔点低
B.合金一定是金属熔合而成的
C.合金的硬度和强度一般比纯金属高
D.硬铝、黄铜、钢均为合金
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是 ( )。
A.患口腔溃疡时我们可服用维生素B2,它存在于牛奶和蛋黄等食物中
B.多吃胡萝卜可预防夜盲症,因其中含有丰富的维生素A
C.维生素C具有止血功能,所以被称为抗坏血酸
D.维生素K是凝血酶元的主要成分,它是止血的功臣
查看答案和解析>>
科目:高中化学 来源: 题型:
五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12 m) | 37 | 71 | 74 | 75 | 186 |
| 主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
下列说法正确的是 ( )。
A.由Q与Y形成的化合物中只存在离子键
B.Z与X之间形成的化合物具有还原性
C.由X、Y、Z三种元素形成的化合物,其晶体一定是分子晶体
D.Y与W形成的化合物中,Y显负价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com