
 O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
O2(g)=H2O(l) ΔH3=-285.8 kJ/mol| A.-488.3 kJ/mol | B.-191 kJ/mol | C.-476.8 kJ/mol | D.-1 549.6 kJ/mol |
科目:高中化学 来源:不详 题型:填空题
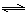 CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。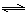 2CO(g) △H1
2CO(g) △H1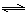 H2(g)+CO2(g) △H2
H2(g)+CO2(g) △H2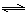 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3  H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :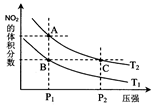
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1 2NO2(g) ΔH="-113.0" kJ·mol
2NO2(g) ΔH="-113.0" kJ·mol SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH2=-285.8 kJ·mol-1| A.ΔH=+244.1 kJ·mol-1 |
| B.ΔH=-488.3 kJ·mol-1 |
| C.ΔH=-996.6 kJ·mol-1 |
| D.ΔH=+996.6 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)=H2O(g); DH1=akJ·mol-1
O2(g)=H2O(g); DH1=akJ·mol-1 O2(g)=H2O(l) ; DH3=c kJ·mol-1
O2(g)=H2O(l) ; DH3=c kJ·mol-1| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
 ,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,下图(1)是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。


 ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:| c(HCO3-)∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com