
| A. |  | B. |  | ||
| C. |  | D. |  |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
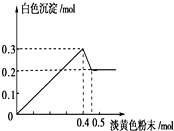 有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如图所示.
有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 N | |
| C. | 通常状况下,1 NA个CO2分子占有的体积为22.4L | |
| D. | 标准状况下,22.4L CO2和SO2混合气中氧原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3=Na++H++CO32- | B. | NaOH=Na++OH- | ||
| C. | H2SO4=2H++SO42- | D. | KCl=K++Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含4 mol HCl 的浓盐酸跟足量MnO2加热反应可制得 Cl2的分子数为NA | |
| B. | 将标准状况下 22.4LNO与11.2LO2混合后的体积约为 22.4L | |
| C. | 标准状况下,22.4L乙烯中含有σ键的数目为5NA | |
| D. | 1molC(金刚石)中含有C-C键的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
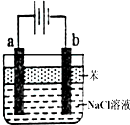 (1)用惰性电极电解饱和食盐水的反应方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(1)用惰性电极电解饱和食盐水的反应方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、H2S、O2 | B. | CO、H2、Cl2 | C. | NO、H2、O2 | D. | HCl、CO、NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com