

| A、滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B、样品中CuO的质量为4.0g |
| C、V=448 |
| D、原样品中Fe元素的质量分数为41% |
| 3.2g |
| 64g/mol |
| 3.2g |
| 160g/mol |
| 5.76g-3.2g-2.24g |
| 16g/mol |
| 2.24g |
| 5.76g |


科目:高中化学 来源: 题型:
| A、1mol水中含有1mol氧原子和2mol氢原子 |
| B、摩尔是化学上常用的一个物理量 |
| C、某硫酸溶液中H2SO4的质量分数为0.6 |
| D、阿伏加德罗常数约为6.02×1023mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冰醋酸、消石灰、明矾、生石灰分别属于酸、碱、盐、氧化物 |
| B、电解质在水溶液和熔融状态下均一定能导电 |
| C、电解、电泳、电镀需要通电才可进行,而电离、原电池导致的腐蚀不需要通电 |
| D、物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
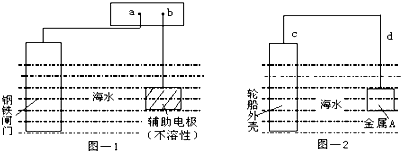
| A、图-1:a为电源正极 |
| B、图-1:辅助电极上发生氧化反应 |
| C、图-2:电流方向d→c |
| D、图-2:金属A可以是耐腐蚀的金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测中和热的数值 |
| B、配置一定物质的量浓度溶液时,定容后反复摇匀发现液面低于刻度,没有再加水,所得溶液的浓度 |
| C、配制一定物质的量浓度溶液时,用量筒量取浓溶液的体积时仰视读数,所得溶液的浓度 |
| D、用天平称量20.5g某物质,砝码和药品的位置放反,所得药品的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、②④ | D、⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光照甲烷与氯气的混和物,乙烯使酸性高锰酸钾溶液褪色 | |||
B、CH3CH2-OH+H-O-C2H5
| |||
| C、乙烯使溴的四氯化碳溶液褪色,苯与氢气在一定条件下反应生成环己烷 | |||
| D、在苯中滴入溴水,溴水褪色,乙烯使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 物质 A、B 的溶解度曲线如图所示(A、B 均不与水反应且不含结晶水),下列叙述中正确的是( )
物质 A、B 的溶解度曲线如图所示(A、B 均不与水反应且不含结晶水),下列叙述中正确的是( )| A、T1℃时,A、B 饱和溶液中,A 溶液的溶质的质量分数较小 |
| B、T2℃时,A、B 饱和溶液的物质的量浓度相等 |
| C、可用加热浓缩、降温结晶的方法除去 B 中混有的少量 A |
| D、T1℃时 A、B 的饱和溶液升温至 T3℃时,B 溶液的溶质的质量分数较大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com