
(7分)分别取40mL的0.50 mol/L盐酸与40mL的0.55 mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1 mol 水时放出57.3 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式__________________________________。
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是_____________________________________________;

(3)假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)。为了计算中和热,实验时还需测量的数据有(填序号)________。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
|
实验 序号 |
起始温度t1/℃ |
终止温度t2/℃ |
|
|
盐酸 |
氢氧化钠 |
混合溶液 |
|
|
1 |
20.0 |
20.1 |
23.2 |
|
2 |
20.2 |
20.4 |
23.4 |
|
3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________;
(1)NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol(2分)
(2)减少热量损失(1分)
(3)ACE(2分) (4)-51.8 kJ/mol (2分)
【解析】(1)在稀水溶液中,酸碱中和生成盐和1mol水时放出的热量;
(2)因该反应要测反应中放出的热量,为提高实验结果的准确性,故当然要减少热量损失;
(3)利用关系式:Q=-C(T2-T1),可以看出:选ACE;
(4)以第一组实验为例:t1=(20.0+20.1)/2=20.05℃,则公式中(T2-T1)=23.2-20.05=3.15℃;
同理,第二组实验中,(T2-T1)=3.1℃;第三组实验中,(T2-T1)=3.05℃;
则三组实验的(T2-T1)平均值为3.1℃,带入关系式,得:
Q=-4.18 J/(g·℃)×80 g×3.1℃=1.03664KJ
则生成1mol水时放出的热量=1.03664KJ÷0.02mol×1mol=51.8 KJ,即ΔH=-51.8 kJ/mol


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
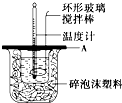 分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.| 实验 序号 |
起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
(2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H (填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和NaOH溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18×10-3 kJ/(g·℃)。为了计算中和热,某学生实验记录数据如下:
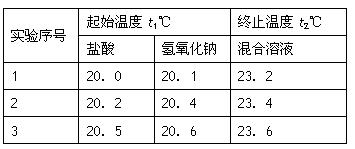

依据该学生的实验数据计算,该实验测得的中和热△H=___________;(结果保留一位小数)
(4)若用0.50mol/L醋酸代替盐酸和氢氧化钠溶液反应则测得中和热会 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
(2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H (填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和NaOH溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18×10-3 kJ/(g·℃)。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热△H=___________;(结果保留一位小数)
(4)若用0.50mol/L醋酸代替盐酸和氢氧化钠溶液反应则测得中和热会 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com