
| A. | 与电源正极相连的是电解槽的阴极 | |
| B. | 与电源负极相连的电极发生还原反应 | |
| C. | 在电解槽的阳极发生氧化反应 | |
| D. | 电子从电源的负极沿导线流入阴极 |
分析 A、与电源正极相连的电极是电解池的阳极;
B、与电源负极相连的电极为阴极;
C、电解池中阳极上发生失电子的氧化反应;
D、依据电解原理分析,电子从电源的负极沿导线流入电解槽的阴极,通过电解质溶液中离子定向移动发生氧化还原反应,电子在阳极流回到电源正极.
解答 解:A、与电源正极相连的是电解槽的阳极,故A错误;
B、与电源负极相连的电极为阴极,发生还原反应,故B正确;
C、电解池中阳极上发生失电子的氧化反应,故C正确;
D、电子从电源的负极沿导线流入电解槽的阴极,通过电解质溶液中离子定向移动发生氧化还原反应,电子在阳极流回到电源正极,故D正确;
故选A.
点评 本题考查了电解原理的分析应用,电极名称和电极判断是解题关键,掌握基础是解题关键,题目难度中等


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
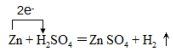 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
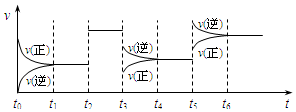 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是| A. | t2时加入了催化剂 | B. | t3时降低了温度 | ||
| C. | t5时升高了温度 | D. | t4~t5时间内转化率一定最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b>c>a | B. | b>a>c | C. | c>b>a | D. | a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ•mol-1 |
| A.1.0mol/L HCl溶液50mL、1.1mol/L NaOH溶液50mL | 13.0 | 19.8℃ | △H1 |
| B.1.0mol/L HCl溶液50mL、1.1mol/L NH3•H2O溶液50mL | 13.0 | 19.3℃ | △H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com