
 如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法不正确的是( )
如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列说法不正确的是( )| A. | 左边的电极为电池的负极,a处通入的是甲醇 | |
| B. | 每消耗3.2 g氧气转移的电子为0.4 mol | |
| C. | 电池负极的反应式为:CH3OH+H2O-6e-═CO2+6H+ | |
| D. | 电池的正极反应式为:O2+2H2O+4e-═4OH- |
分析 由电子的方向可知a为负极,b为正极,甲醇在负极被氧化,由题意可知生成CO2和H+,负极反应为CH3OH+H2O-6e-=CO2+6H+,氧气在正极得电子被还原,生成水,正极反应式为O2+4e-+4H+=2H2O,以此解答该题.
解答 解:A、依据图中电子流向分析,原电池中电子是从负极流向正极;电子流出的一端是负极,失电子发生氧化反应;所以a处是失电子的一端,通的是甲醇,故A正确;
B、正极是氧气得到电子发生还原反应,反应式为O2+4e-+4H+=2H2O,则每消耗3.2 g氧气转移的电子为0.4 mol,故B正确;
C、负极是甲醇失电子发生氧化反应,依据电池反应和酸性环境,2CH3OH+3O2=2CO2+4H2O,负极电极反应为:CH3OH+H2O-6e-=CO2+6H+,故C正确;
D、正极是氧气得到电子发生还原反应,氧气得到电子生成氢氧根离子,在图中是酸性介质,电极反应产物应写成水的形式;电池的正极反应式为:O2+4H++4e-=2H2O,故D错误;
故选D.
点评 本题考查了原电池的原理应用,电极判断,电极名称,电极反应,电极反应式书写的分析判断,掌握原电池原理是解题关键,燃料电池的特征是燃料是电子在负极反应,氧气在正极发生还原反应,题目难度中等.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 均为100mL0.1mol/L的两种溶液可中和等物质的量的氢氧化钠 | |
| B. | pH=3的两种溶液稀释100倍,pH都为5 | |
| C. | 相同浓度的两种溶液中c(H+)相同 | |
| D. | 两溶液中分别加入少量对应的钠盐,c(H+)均明显减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N、O、F最高正价依次升高 | |
| B. | 锂、钠、钾、铷单质与水反应置换出氢气越来越难 | |
| C. | F2、Cl2、Br2、I2单质的熔点逐渐降低 | |
| D. | Al3+、Na+、O2-微粒半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂都不能使溴水褪色 | |
| B. | 多糖都属于天然高分子化合物 | |
| C. | 麦芽糖在一定条件下既能发生水解反应,又能发生银镜反应 | |
| D. | 肽键是蛋白质一级结构中的主键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对任何化学反应来说,反应速率越大,反应现象就越明显 | |
| B. | 化学反应速率为“0.8mol•L-1•s-1”所表示的意义是:时间为1s时,某物质的浓度为0.8mol•L-1 | |
| C. | 可逆反应达到化学平衡状态时,当正反应速率增大时,逆反应速率会减小 | |
| D. | 对于放热反应,提高反应温度也能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
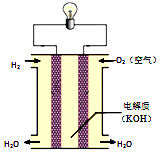
| A. | 通入燃料的一极为负极 | |
| B. | K+、H+向电池的正极移动 | |
| C. | 正、负极材料活泼性不同导致电子发生定向移动 | |
| D. | 借助特殊装置和介质,H2与O2不接触也可发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 皂化反应就是乙酸乙酯等酯类物质在碱性条件下的水解 | |
| B. | 纤维素可以在人体内水解为葡萄糖,而作人类的营养物质 | |
| C. | 豆浆煮沸后蛋白质变成氨基酸 | |
| D. | 食用油反复加热会产生稠环芳烃等有害物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 破坏臭氧层--氮氧化物 | |
| B. | 酸雨--二氧化碳 | |
| C. | 水体富营养化--含N,P 元素多的废水 | |
| D. | 光化学烟雾--二氧化氮 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com