
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2、O2、N2 | B. | SO2、O2、N2、矿尘 | C. | SO2、SO3 | D. | Cl2、Ar、N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H8的有机物可能存在4个C-C单键 | |
| B. |  、 、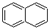 和 和 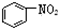 均属于芳香烃 均属于芳香烃 | |
| C. | 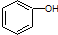 和 和 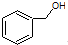 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 结构简式为C2H5-OH的核磁共振氢谱上有2个吸收峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油不能使溴的四氯化碳溶液褪色 | |
| B. | 蔗糖水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 蛋白质能发生水解最终生成氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-) | |
| C. | 已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 | |
| D. | 浓度均为0.1 mol•L-1的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 | |
| B. | 二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理是不相同的 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 乙醇、糖类和蛋白质都是人体必需的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素离子(X-)只有还原性而无氧化性 | |
| B. | 某元素由化合态变成游离态,该元素一定被氧化 | |
| C. | 失电子难的原子获得电子的能力一定强 | |
| D. | 卤素最高价氧化物的分子式都为X2O7 |
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:填空题
常见的非金属元素及化合物的特征性质有着重要的应用,请按要求回答:
(1)C、N、O、Si、S、Cl等元素形成的单质中
①属于空气主要成分它们相互反应的化学方程式_____________________;
②常用于自来水消毒的是实验室制备该气体的化学方程式_____________________。
(2)在CO、CO2、SO2、NO、NO2、SiO2等氧化物中:
①其中属于酸性氧化物的是______________,能形成酸雨的是_____________。
②光导纤维的主要成分与烧碱反应的化学方程式为___________________。
(3)在浓(稀)硝酸、浓(稀)硫酸中:
①常温下能使Fe、Al钝化的是_________。
②见光易分解的反应的化学方程式是:_____________________。
(4)在H2O2、NH3、HCl中:
①被称作绿色氧化剂,它与FeSO4酸性溶液反应的离子方程式为_______________________。
②可用于制氮肥、纯碱,加热条件下与氧气反应的化学方程式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com