
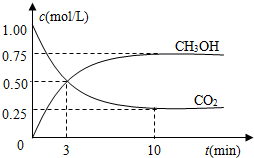
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.| n(CH3OH) |
| n(CO2) |
| △c |
| △t |
 CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),| △c |
| △t |
| 2.25mol/L |
| 10min |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
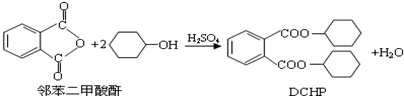
| A、DCHP的分子式为C20H28O4 |
| B、上述制备DCHP的反应属于取代反应 |
| C、DCHP苯环上的一氯代物有4种 |
| D、1mol DCHP最多可与含4mol NaOH的溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
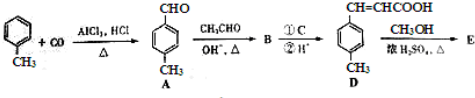
| OH-,△ |
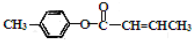 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
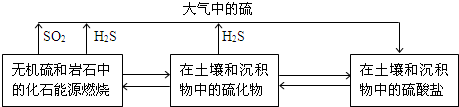
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | A的最高价氧化物对应的水化物化学式为H2AO3 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
| D | D的基态原子最外层电子排布式为3s23p2 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“地沟油”、“塑化剂”(邻苯二甲酸酯类物质)均属于高分子化合物,都对健康有害 |
| B、明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
| C、红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
| D、含钙、钡等金属元素的物质有绚丽的颜色,可用于制造焰火 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
 |
 |
 |
 |
| 成分为二氧化硅 | 要检测其中的碘元素 | 铁管与铜管二者相连 | 用自来水养金鱼时需要先“晒水” |
| 一种常见的硅酸盐材料 | 先将其还原为单质,再加淀粉 | 铁管不易腐蚀 | 目的是使水温升高 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
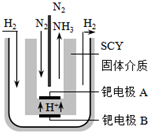 随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图).下列有关说法中正确的是( )
随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图).下列有关说法中正确的是( )| A、电解法合成氨的电解池中能用水作电解质溶液的溶剂 |
| B、钯电极B连接的是电源的负极 |
| C、钯电极A的电极反应式为:N2+6e-+6H+═2NH3 |
| D、当有0.3mol电子转移时,有2.688L NH3生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若B为强碱,则A一定为金属钠 |
| B、若B为强酸,则A一定为氯气 |
| C、若C为H2,则H2O一定作氧化剂 |
| D、若C为O2,则H2O一定作还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com