
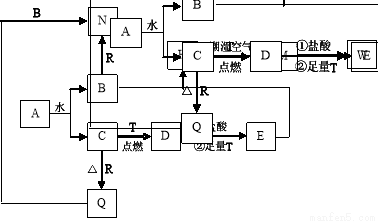
��12 �֣����������Ҫ�ɷ�ΪFeTiO3(�ɱ�ʾΪFeO��TiO2)����������MgO��CaO��SiO2�����ʡ������������Ʊ�����ӵ�ص缫����(�����Li4Ti5O12�����������LiFePO4)�Ĺ�ҵ��������ͼ��ʾ��
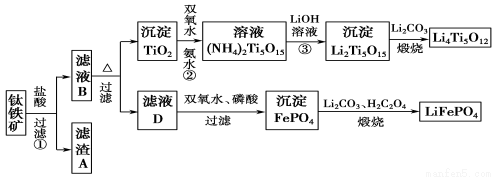
��֪��FeTiO3�����ᷴӦ�����ӷ���ʽΪ��FeTiO3��4H����4Cl��===Fe2����TiOCl42����2H2O��
��1������ʵ���������չ���������õ����ֹ������ʵ������������������ƾ��ơ��������⣬���� (����������)�������ж���漰��������ϴ�ӳ����ķ����� ��
��2����������������A�Ʊ��뵼��ķ�Ӧ�� ��
��3����ҺB��TiOCl42��ת������TiO2�����ӷ���ʽ�� ��
��4����Ӧ���й���TiO2ת����(NH4)2Ti5O15��Һʱ��TiԪ�صĽ������뷴Ӧ�¶��йأ���Ӧ�¶ȹ���ʱ��TiԪ�ؽ����ʻ��½�����ԭ���� ��
��5��д������ҺD����FePO4�����ӷ���ʽ ������ҺD�Ʊ�LiFePO4�Ĺ����У�����˫��ˮ��H2C2O4�����ʵ������� ��
(1)���� ��©���м�������ˮ����û��������ˮ��Ȼ���º��ظ����ϲ���2��3�Ρ�
(2)2C��SiO2 Si��2CO�� (3)TiOCl42����H2O
Si��2CO�� (3)TiOCl42����H2O TiO2����2H����4Cl��
TiO2����2H����4Cl��
(4)�¶ȹ���ʱ����Ӧ�ﰱˮ(��˫��ˮ)�����ȷֽ� (5)2Fe2+ + 2H3PO4 + H2O2 === 2FePO4��+ 2H2O + 4H+��
1��1
��������
�����������1�����չ�������õ��Ĺ������ʵ������������������ƾ��ơ��������⣬����������ϴ�ӳ����ķ�������©���м�������ˮ����û��������ˮ��Ȼ���º��ظ����ϲ���2��3�Σ���2�����������ж������費�������ᣬ��������A�ɷ��Ƕ������裬�뵼������ǹ裬����A�ư뵼��ķ�Ӧ�ǣ�2C��SiO2 Si��2CO������3���������̿�֪��TiOCl42-����Һ�м�����ˮ��Ӧ���ɶ������ѳ�������Ӧ�����ӷ���ʽΪ��TiOCl42-+H2O=TiO2��+2H++4Cl-����4�����ڶ��������백ˮ��˫��ˮ��Ӧ����NH4��2Ti5O15ʱ���¶ȹ��ߣ�˫��ˮ�Ͱ�ˮ�����ֽ⣬���Է�Ӧ�¶ȹ���ʱ��TiԪ�ؽ������½�����5����ҺD���Ȼ�������Һ����˫��ˮ�����ᱻ����Ϊ�����������ӷ���ʽΪ��2Fe2+ + 2H3PO4 + H2O2 === 2FePO4��+ 2H2O + 4H+����˿ɵù�ϵʽ��H2O2��H2C2O4����˫��ˮ����� ���ʵ���֮��Ϊ1��1��
Si��2CO������3���������̿�֪��TiOCl42-����Һ�м�����ˮ��Ӧ���ɶ������ѳ�������Ӧ�����ӷ���ʽΪ��TiOCl42-+H2O=TiO2��+2H++4Cl-����4�����ڶ��������백ˮ��˫��ˮ��Ӧ����NH4��2Ti5O15ʱ���¶ȹ��ߣ�˫��ˮ�Ͱ�ˮ�����ֽ⣬���Է�Ӧ�¶ȹ���ʱ��TiԪ�ؽ������½�����5����ҺD���Ȼ�������Һ����˫��ˮ�����ᱻ����Ϊ�����������ӷ���ʽΪ��2Fe2+ + 2H3PO4 + H2O2 === 2FePO4��+ 2H2O + 4H+����˿ɵù�ϵʽ��H2O2��H2C2O4����˫��ˮ����� ���ʵ���֮��Ϊ1��1��
���㣺��ѧʵ�鷽�������������


 ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ2015�����9�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��4�ֻ����Һ���ֱ��ɵ����0.1mol/L��2����Һ��϶��ɣ� ��CH3COON��HCl��CH3COONa��NaOH ��H3COONa��NaCl ��H3COONa��NaHCO3�����и���������ȷ����
A��pH: ��>��>��>�� B�� c(CH3COO��)����>��>��>��
C����Һ��c(H��): ��>��>��>�� D��c(CH3COOH): ��>��>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ������
��10�֣����ڵؿ��еĺ����ϸߣ��輰�仯����Ŀ��������Ѿã����ִ��������й㷺Ӧ�ã��ش��������⣺
��1���մɡ�ˮ��Ͳ����dz��õĴ�ͳ�����ǽ������ϣ�����������ͨ��������Ҫԭ���� ��
��2���ߴ������ִ���Ϣ���뵼��������Ȳ�ҵ����Ҫ�Ļ������ϣ���ҵ���ᴿ���ж���·�ߣ�����һ�ֹ�������ʾ��ͼ����Ҫ��Ӧ��ͼ��
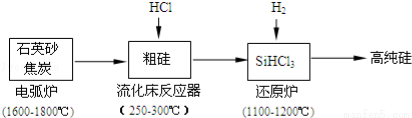
�ٹ�ҵ����ʯӢɰ�ͽ�̿�ڵ绡¯�и��¼��ȵ�1600�橁1800������ɴֹ��⣬Ҳ��������̼���裬���ڵ绡¯�ڿ��ܷ����ķ�Ӧ�Ļ�ѧ����ʽΪ ��
������������Ӧ�IJ����У�SiHCl3��Լռ85%������SiCl4��SiH2Cl2��SiH3Cl�ȣ��ֹ�����SiHCl3�Ļ�ѧ��Ӧ����ʽ ��
��3���й����ʵķе��������±����ᴿSiHCl3����Ҫ���ղ��������dz����������� ��SiHCl3����ˮ�⣬����ȫˮ��IJ���Ϊ ��
���� | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
�е�/�� | 2355 | 57.6 | 31.8 | 8.2 | ��30.4 | ��84.9 | ��111.9 |
��4����ԭ¯�з����Ļ�ѧ��ӦΪ�� ��
��5���ȼҵ��Ϊ�������������ṩ����ԭ�ϣ���Щԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���жԻ�ѧ��ѧ����֪�������
A����ѧ��һ����ʵ��Ϊ��������Ȼ��ѧ
B����ѧ�ҿ����������Ȼ���в����ڵ�����
C�����ʷ�����ѧ��Ӧ�������������仯
D����ѧ�о���������صĻ�����Ⱦ�������ս������ڻ�ѧ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ��������ϰ�ࣩ10���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
Ϊ��ȥij���������������ʣ���ѡ�õ��Լ������������ȷ����
��� | ���� | ���� | ������Ӧѡ�õ��Լ���������� |
�� | KNO3��Һ | KOH | ����ϡHNO3��ͬʱ��pH��ֽ�ⶨ����Һ������ |
�� | FeSO4��Һ | CuSO4 | ����������۲����� |
�� | H2 | CO2 | ����ͨ��ʢ��NaOH��Һ��Ũ�����ϴ��ƿ |
�� | NaNO3 | CaCO3 | �ܽ⡢���ˡ��������ᾧ |
A���٢ڢ� B���ڢۢ� C���٢ۢ� D���٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ�����������11��ͳһ��⻯ѧ�Ծ��������棩 ���ͣ������
��11�֣���1�������������ʵ������գ���NaF ��C2H4 ��Na2O2 �� Ba(OH)2 �� CO2��ֻ���м��Լ����� ���������Ӽ����зǼ��Լ����� ��
��2��C��N��O����Ԫ�صĵ�һ�������ɴ�С��˳���� ��ij������MO�ĵ���������SiC����ȣ���MΪ (��Ԫ�ط���)��MO�����������²��ϣ��侧��ṹ��NaCl�������ơ�MO���۵��CaO�ĸߣ���ԭ���� ��
��3����ͭ�ڹ�ҵ����Ҫ�������쵼�ߡ�����Ԫ���ȣ�ͭ���γɣ�1�ͣ�2�۵Ļ�����ش��������⣺
��д����̬Cu2���ĺ�������Ų�ʽ�� �������ڱ��е�λ���� ��
����ͼ��ͭ��ij��������ľ���ʾ��ͼ����������Ļ�ѧʽΪ ��
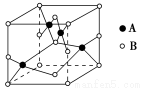
��CuO������ת��ΪCu2O����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ�����������11��ͳһ��⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪A��BΪ���ʣ�CΪ����� ����ʵ������ת����ϵ����
����ʵ������ת����ϵ����
����C����ˮ��õ�ǿ����Һ����A������Na
����C����Һ��Na2CO3�ų�CO2���壬��A������H2
����C����Һ�еμ�KSCN��Һ�Ժ�ɫ����B����ΪFe
����C����Һ�еμ�NaOH��Һ����ɫ�������ɣ���B����ΪCu
A.�٢� B.�ڢ� C.�٢� D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�켪��ʡ���������ѧУ������ѧ���������ۻ�ѧ�Ծ��������棩 ���ͣ������
��14�֣���֪AΪ����ɫ���壬T��RΪ���ֳ�������;�ܹ�Ľ������ʣ�D�Ǿ��д��Եĺ�ɫ���壬C����ɫ��ζ�����壬H�ǰ�ɫ���������ڳ�ʪ������Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ���塣
��1��д���������ʵĻ�ѧʽ��D��____________��R��_______________��
д���������ʵĵ���ʽA�� ��
��2����Ҫ��д���з�Ӧ����ʽ��
H�ڳ�ʪ�����б��M�Ĺ����еĻ�ѧ����ʽ��__________________��
B��R��Ӧ�Ļ�ѧ����ʽ��___________________________ ��
D�����ᷴӦ�����ӷ���ʽ��________________________��
��3�����ˮ�м���W������Һ�����Ƶ�һ�ֺ��ɫ���壬�÷�Ӧ�����ӷ���ʽΪ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�켪��ʡ����10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������ͼ��ʾʵ��װ��(�г���������ȥ)̽��ͭ˿�����Ũ����ķ�Ӧ������ʵ�鲻��������( )
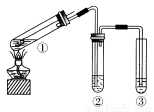
A�������ƶ�����ͭ˿�ɿ���SO2����
B������ѡ��Ʒ����Һ��֤SO2������
C������ѡ��NaOH��Һ���ն����SO2
D��Ϊȷ��CuSO4���ɣ�����м�ˮ���۲���ɫ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com