
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H═-368.15 kJ•mol-1 | |
| B. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H═-736.3 kJ•mol-1 | |
| C. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H═-675.3 kJ•mol-1 | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H═-1 472.6 kJ•mol-1 |
分析 燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,16g甲醇完全燃烧放出368.15kJ的热量,32g甲醇燃烧生成CO2和液态水时放热368.15kJ×2=736.3kJ,1mol甲醇质量为32克,所以完全燃烧1mol甲醇生成二氧化碳和液态水放热736.3kJ.
解答 解:燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,16g甲醇完全燃烧放出368.15kJ的热量,32g甲醇燃烧生成CO2和液态水时放热368.15kJ×2=736.3kJ,1mol甲醇质量为32克,所以完全燃烧1mol甲醇生成二氧化碳和液态水放热736.3kJ,表示甲醇标准燃烧热的热化学方程式是CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H═-736.3 kJ•mol-1,故选B.
点评 本题考查了热化学方程式的书写,题目难度中等,注意掌握热化学方程式的意义是关键,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
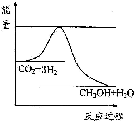 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.| 起始 浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| X | Y | Z | |
| 第一电离能(KJ/mol) | 526.2 | 502.8 | 425.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁醛 | B. | 正丁醛的同系物 | ||
| C. | CH3CH2COCH3 (2-丁酮) | D. | CH2=C(CH3)CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6mol/L | B. | 1mol/L | C. | 1.2mol/L | D. | 0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫能使溴水褪色,说明二氧化硫具有漂白性 | |
| B. | 漂白粉和明矾都常用于处理自来水,二者的作用的原理相同 | |
| C. | 检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可用酸性高锰酸钾溶液 | |
| D. | 金属单质Na、Al、Fe在一定条件下与水反应都生成氢气和对应的碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com