
| A、只用溴水一种试剂可鉴别甲苯、乙烯、乙醇、四氯化碳四种液体 |
| B、将乙醇加热到170℃可制得乙烯 |
| C、用乙醇、冰醋酸及pH=0的H2SO4加热可制乙酸乙酯 |
| D、用饱和的Na2CO3溶液除去CO2中的HCl |


科目:高中化学 来源: 题型:
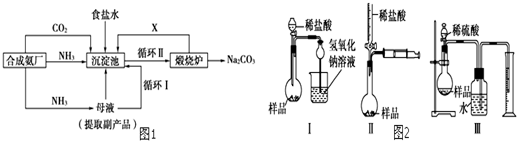
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 钙是人体神经、骨骼系统等功能功能正常动作所必需的常量元素.某药业公司的钙片包装上有如下说明:
钙是人体神经、骨骼系统等功能功能正常动作所必需的常量元素.某药业公司的钙片包装上有如下说明:| 性状 | 本品为白色片 |
| 贮藏 | 密封,干燥处保存 |
| 规格 | 每片含碳酸钙0.5g(相当于钙0.2g) |
| 包装 | |
| 生产批号 | |
| 生产日期 | |
| 有效期至 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40% | B、50% |
| C、60% | D、70% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| [B] |
| [OH-] |
| [OH-] |
| [H+] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.5a×10-4mol |
| B、5a×10-4mol |
| C、7.5a×10-4mol |
| D、a×10-3mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com