
| A. | 0~10min内,v(NO)=0.01mol.L-1.min-1 | |
| B. | 若保持其他条件下不变,加入催化剂,则△H不变 | |
| C. | 若升高温度,平衡向逆反应方向移动,则△H>0 | |
| D. | 若平衡后向容器中再加入0.1mol NaCl,则NO2的转化率增大 |
分析 在恒温条件下,向2L恒容密闭容器中加入0.4mol NO2和0.2mol NaCl,10min反应达到平衡时n(NaNO3)=0.1mol,依据平衡三段式列式计算;
4NO2(g)+2NaCl(s)═2NaNO3(s)+2NO(g)+Cl2(g),
起始量(mol) 0.4 0.2 0 0 0
变化量(mol) 0.2 0.1 0.1 0.1 0.05
平衡量(mol) 0.2 0.1 0.1 0.1 0.05
A、根据三行式结合公式v(NO)=$\frac{△c}{△t}$,来分析解答;
B.催化剂改变反应速率不改变化学平衡,反应热不变;
C.升温化学平衡向吸热反应方向进行;
D.固体不影响化学平衡;
解答 解:在恒温条件下,向2L恒容密闭容器中加入0.4mol NO2和0.2mol NaCl,10min反应达到平衡时n(NaNO3)=0.1mol,依据平衡三段式列式计算;
4NO2(g)+2NaCl(s)═2NaNO3(s)+2NO(g)+Cl2(g),
起始量(mol) 0.4 0.2 0 0 0
变化量(mol) 0.2 0.1 0.1 0.1 0.05
平衡量(mol) 0.2 0.1 0.1 0.1 0.05
A、根据公式v(NO)=$\frac{△c}{△t}$=$\frac{\frac{0.1mol}{2L}}{10min}$=0.005mol•L-1•min-1,故A错误;
B.若保持其他条件下不变,加入催化剂,改变的是反应速率,化学平衡不变,则△H不变,故B正确;
C.若升高温度,平衡向逆反应方向移动,逆向为吸热反应,则正反应为放热反应,则△H<0,故C错误;
D.若平衡后向容器中再加入0.1mol NaCl是固体,对化学平衡无影响,则NO2的转化率不变,故D错误;
故选B.
点评 本题考查了影响化学平衡影响因素分析,化学平衡的计算等知识点,注意固体不影响化学平衡,题目难度中等.


科目:高中化学 来源: 题型:解答题
 钛(Ti)被称为继铁、铝之后的第三金属,四川攀枝花和西昌地区的钒钛磁铁矿储量十分丰富.如右图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.据此作答:
钛(Ti)被称为继铁、铝之后的第三金属,四川攀枝花和西昌地区的钒钛磁铁矿储量十分丰富.如右图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.据此作答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,11.2升CCl4中含有氯原子的数目为2 NA | |
| B. | 500mL 0.5mol/L的Na2CO3溶液中,含有CO32-的数目小于0.25NA | |
| C. | 常温下电解NaNO3溶液,当阳极产生气体22.4升时,转移电子的数目为4NA | |
| D. | 将0.1 mol N2和0.3 mol H2置于密闭容中充分反应,可得0.2NA个NH3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量 | B. | 密度 | C. | 分子总数 | D. | 质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
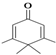 如图所示的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来命名为Penguinone.下列有关Penguinone的说法不正确的是( )
如图所示的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来命名为Penguinone.下列有关Penguinone的说法不正确的是( )| A. | Penguinone中存在两种官能团 | |
| B. | Penguinone是一种芳香醛 | |
| C. | Penguinone中存在与乙烯相同的官能团,所以其与乙烯有相似的性质 | |
| D. | 如果该分子中的双键都能加成,则1 mol Penguinone能与3 mol氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、BaSO4、O2 | B. | FeCl2 溶液、Fe 粉、Cl2 | ||
| C. | H2O、CaCO3、SO3气体 | D. | H2O、SiO2、HCl 气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com