
 N2(g)+2CO2(g)
N2(g)+2CO2(g) N2(g) +2CO2(g)的△H=___________。
N2(g) +2CO2(g)的△H=___________。
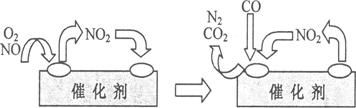
 4CO2+N2(2分、)
4CO2+N2(2分、)  N2(g) +2CO2(g),所以该反应的△H=-393.5 kJ/mol×2-180.5kJ/mol+221kJ/mol=-746.5 kJ/mol。
N2(g) +2CO2(g),所以该反应的△H=-393.5 kJ/mol×2-180.5kJ/mol+221kJ/mol=-746.5 kJ/mol。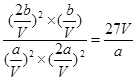 。
。 4CO2+N2。
4CO2+N2。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.元素电负性越大,元素第一电离能越大 |
| B.键能越大,键长越长,共价化合物越稳定 |
| C.副族元素中没有非金属元素 |
| D.离子化合物的熔点一定比共价化合物的高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.凡是放热反应都是自发的,吸热反应都是非自发的 |
| B.某反应ΔH=-122KJ·mol-1,ΔS=231J·mol-1·k -1,此反应任何温度下都不能自发进行 |
| C.活化分子之间发生的碰撞不一定为有效碰撞 |
| D.对有气体参加的化学反应,减小体积增大体系压强,可使单位体积内活化分子数增加,因而反应速率增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学键是一种静电引力 |
| B.化学键可以使离子结合,也可以使原子结合 |
| C.只要有旧健的断裂就一定是化学反应 |
| D.氢键是一种化学键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由分子构成的物质一定含有共价键 |
| B.由非金属元素组成的化合物不一定是共价化合物 |
| C.非极性键只存在于双原子单质分子中 |
| D.不同元素组成的多原子分子中的化学键一定都是极性键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HF、HCl 、HBr、HI的溶沸点依次升高 |
| B.在气态单质分子中,一定存在共价键 |
| C.只含离子键的化合物才是离子化合物 |
| D.在共价化合物中,一定存在着共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com