
| A. | 测定溶液pH时,pH试纸先用蒸馏水润湿 | |
| B. | 蒸馏实验中,蒸馏前必须在蒸馏烧瓶中加入碎瓷片 | |
| C. | 用盐酸滴定滴定氨水实验中,用甲基橙作指示剂以减小实验误差 | |
| D. |  用如图所示的方法排除碱式滴定管胶管中的气泡 用如图所示的方法排除碱式滴定管胶管中的气泡 |
分析 A.将pH试纸润湿相当于把溶液稀释;
B.蒸馏时,加入碎瓷片可防止液体暴沸;
C.氯化铵溶液呈酸性;
D.挤压时尖嘴向上,易于空气排出.
解答 解:A.将pH试纸润湿相当于把溶液稀释,所以不能先将pH试纸润湿,再用玻璃棒蘸取溶液滴在试纸上,跟标准比色卡对照,故A错误;
B.通常我们会在蒸馏烧瓶中加入少量碎瓷片或者沸石,形成溶液的爆沸中心,防止液体爆沸,故B正确;
C.氯化铵溶液呈弱酸性,甲基橙的变色范围是3.1-4.4,用酸滴定碱时,甲基橙加在碱里,达到滴定终点时,溶液颜色由黄变红,易于观察,故C正确;
D.挤压时尖嘴向上,易于空气排出,图中挤压橡胶管中的操作合理,故D正确.
故选A.
点评 本题考查常见仪器的使用和化学基本操作的方法,难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
 ,产物的结构简式为
,产物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用饱和食盐水除去Cl2中少量的HCl | |
| B. | 往溴水中通入SO2,可检验SO2的还原性和漂白性 | |
| C. | 往溶液加入盐酸,产生无色无味且能使澄清石灰水浑浊的气体,该气体一定是CO2 | |
| D. | 用硝酸酸化的氯化钡溶液检验某溶液中是否含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2 | B. | △H2=△H1+△H4 | C. | △H3=△H2-△H5 | D. | △H4<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
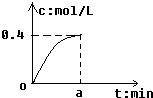 反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 0.1 | B. | 2.5 | C. | 5 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com