
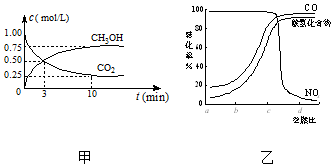
 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.分析 (1)从充分利用太阳能的角度分析;
(2)①根据v=$\frac{△c}{△t}$计算反应速率,计算二氧化碳反应速率,反应速率之比等于化学方程式计量数之比;
②化学反应达到平衡状态时正逆反应速率相等,各物质的浓度不变,由此衍生的物理量不变;
(3)根据反应物判断可能的生成物,反应物有氨气和磷酸,则复合肥料可能为磷酸铵盐;
(4)NO和CO的转化率越高,催化效果越好.
解答 解:(1)电解水、高温以及天然气的使用都会消耗能源,不符合低碳要求,使用太阳能可减小低碳,故答案为:C;
(2)①v(CO2)=$\frac{△c}{△t}$=$\frac{0.25mol/L}{7min}$,反应速率之比等于化学方程式计量数之比,则v(H2)=3v(CO2)=3×$\frac{0.25mol/L}{7min}$=0.11mol/(L•min)-1,故答案为:0.11;
②A.反应中CO2与CH3OH的物质的量浓度之比为1:1时,没有达到平衡状态,故A错误;
B.由于气体的总质量不变,容器的体积不变,则无论是否达到平衡状态,气体的密度都不变,故B错误;
C.化学反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在单位时间内每消耗3molH2,同时生成1molH2O,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确.
故答案为:D;
(3)反应物有氨气和磷酸,则复合肥料可能为(NH4)3PO4 等,故答案为:(NH4)3PO4;
(4)在c点时NO和CO的转化率最高,催化效果最好,故答案为:c.
点评 本题考查较为综合,设计化学反应速率、化学平衡,环境污染等问题,题目难度中等,本题易错点为(4),注意加强对图象的分析能力的培养.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:
把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛浓盐酸的分液漏斗可用长颈漏斗代替 | |
| B. | 可在集气瓶口放一张湿润的淀粉碘化钾试纸,观察氯气是否收集满 | |
| C. | 用饱和食盐水吸收尾气 | |
| D. | 为了便于学生观察氯气的制备实验,可在讲台上直接做氯气的制备实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

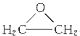 +CaCl2+H2O,该反应的原子利用率25.4%.
+CaCl2+H2O,该反应的原子利用率25.4%. ,
, )与乙二醇作用,可生成一系列化合物:
)与乙二醇作用,可生成一系列化合物: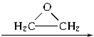 HO-CH2-CH2-O-CH2-CH2-OH
HO-CH2-CH2-O-CH2-CH2-OH
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com