
 用如图所示装置(夹持仪器已省略)进行实验,E为分液漏斗活塞.将液体A逐滴加入到固体B 中,请回答下列问题:
用如图所示装置(夹持仪器已省略)进行实验,E为分液漏斗活塞.将液体A逐滴加入到固体B 中,请回答下列问题:
| ||
| ||


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
| A、加水 |
| B、加热 |
| C、加CH3COONa固体 |
| D、加很稀的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
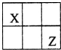 短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法不正确的是( )| A、原子半径:Y>Z>W |
| B、一定条件下,Y可置换出X |
| C、气态氢化物稳定性:Z>W |
| D、熔点YW2>XW4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室用排饱和食盐水而不用排水法收集氯气 |
| B、加催化剂,使N2和H2在一定条件下转化为NH3 |
| C、合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
| D、光照新制的氯水时,溶液中c(H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeSO4在反应中作氧化剂 |
| B、随着反应的进行,该废水的pH会减小 |
| C、若该反应转移0.6mol e-,则会有0.2mol Cr2O72- 被还原 |
| D、除去废水中含铬元素离子的过程包括氧化还原反应和复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com