
【题目】高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程。

(1)上述流程中可以循环使用的物质有________、________(写化学式)。
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是________(填代号)。
a.84消毒液(NaClO溶液) b.75%酒精c.苯酚
(3)理论上(若不考虑物质循环与制备过程中的损失)1molMnO2可制得________molKMnO4。
(4)操作Ⅰ的名称是________;操作Ⅱ根据KMnO4和K2CO3两物质在________(填性质)上的差异,采用________(填操作步骤)、趁热过滤得到KMnO4粗晶体。
【答案】MnO2 KOH a ![]() 过滤 溶解度 浓缩结晶
过滤 溶解度 浓缩结晶
【解析】
工业流程题中能够循环利用的物质,要么是有循环箭头指示的物质,要么就是前面作为反应物出现,在后续的流程中又作为生成物出现的物质。
(1)纵观整个流程图,KOH和MnO2先作为反应物出现,并在后续的步骤中又都作为生成物而出现,所以这两种物质可以循环使用;
(2)KMnO4杀菌消毒利用的是其强氧化性,题中提供的物质中,84消毒液也是利用强氧化性杀菌消毒的;
(3)纵观整个流程,MnO2首先氧化生成的K2MnO4,然后再由K2MnO4歧化生成的KMnO4,同时也有一部分Mn转变为MnO2,根据升降价守恒,可知产物中![]() ,所以理论上每消耗1mol的MnO2可获得
,所以理论上每消耗1mol的MnO2可获得![]() mol的产品;
mol的产品;
(4)操作Ⅰ即为过滤,目的是除去MnO2;操作Ⅱ利用碳酸钾和高锰酸钾的溶解度差异,通过浓缩结晶获取高锰酸钾晶体,再趁热过滤将高锰酸钾粗晶体分离。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
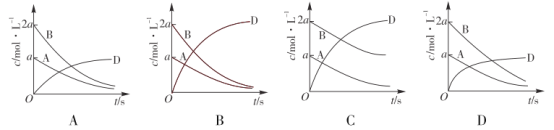
【题目】(1)①已知反应A(g)+B(g)![]() 2D(g),若在起始时c(A)=a mol L-1, c(B)=2amol L-1,则该反应中各物质浓度随时间变化的曲线是_______(选填字母序号)。
2D(g),若在起始时c(A)=a mol L-1, c(B)=2amol L-1,则该反应中各物质浓度随时间变化的曲线是_______(选填字母序号)。
②在298K时,反应A(g)![]() 2B(g)的 KP=0.1132kPa,当分压为 p(A)=p(B)=1kPa时,反应速率υ正______υ逆(填 “ <” “ =” 或 “ >” )。
2B(g)的 KP=0.1132kPa,当分压为 p(A)=p(B)=1kPa时,反应速率υ正______υ逆(填 “ <” “ =” 或 “ >” )。
③温度为 T时,某理想气体反应 A(g)+B(g)![]() C(g)+M(g),其平衡常数 K为0.25,若以 A∶B =1∶1发生反应,则 A的理论转化率为_____%(结果保留3位有效数字)。
C(g)+M(g),其平衡常数 K为0.25,若以 A∶B =1∶1发生反应,则 A的理论转化率为_____%(结果保留3位有效数字)。
(2)富勒烯 C60和 C180可近似看作“ 完美的” 球体,富勒烯的生成时间很快,典型的是毫秒级,在所有的合成技术中得到的 C60的量比 C180的量大得多。已知两个转化反应:反应物![]() 3C60 ,反应物
3C60 ,反应物![]() C180,则势能(活化能)与反应进程的关系正确的是______(选填字母序号)。
C180,则势能(活化能)与反应进程的关系正确的是______(选填字母序号)。

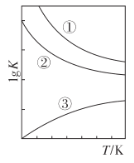
(3)甲醇脱氢和甲醇氧化都可以制取甲醛,但是O2氧化法不可避免地会深度氧化成CO。脱氢法和氧化法涉及的三个化学反应的 lgK随温度 T的变化曲线如图所示。写出图中曲线①的化学反应方程式________;曲线③的化学反应方程式为________;曲线②对应的化学反应是____(填“ 放热” 或“ 吸热” )反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A.在标况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA
B.铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
C.0.1molNa2O2晶体中含有0.4NA个离子
D.常温常压下,16gO3所含的电子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.由三种元素组成的化合物 A,按如下流程进行实验。气体 B 为纯净物,溶液D焰色反应为黄色。
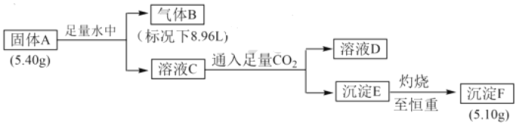
请回答:
(1)组成A的三种元素是____,A 的化学式是_____。
(2)固体A与H2O反应的化学方程式是______。
(3)化合物甲为A中的其中两种元素组成的离子化合物。甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式_____。
II.二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。某小组按照以下实验装置制备ClO2并验证其某些性质。请回答下列问题:
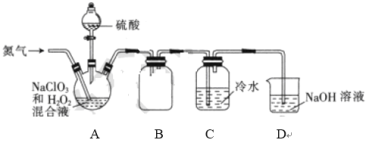
(1)通入氮气的主要作用有2个,分别是____;
(2) A中的硫酸有时也可以用浓盐酸代替, 实验过程中同时还大量生成另一种有色气体单质, 写出化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①在NH4NO3中氮元素显+5价;
②4FeS2+11O2![]() 2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
③2Cu+O2![]() 2CuO反应中Cu元素化合价降低总数与O元素化合价升高总数一定相等。这3种说法中错误的是
2CuO反应中Cu元素化合价降低总数与O元素化合价升高总数一定相等。这3种说法中错误的是
A.①B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质:①.Cu ②.NaCl晶体 ③.NaHSO4 ④.CO2 ⑤.CaO ⑥HCl ⑦.稀H2SO4 ⑧. 熔融Ba(OH)2 ⑨.C2H5OH ⑩.NaCl溶液。
属于电解质的是(填序号,下同)_____,属于非电解质的是_____,能导电的是______。
(2)写出下列物质在水溶液中的电离方程式:
①NaHSO4 ___________________________;
②Al2(SO4)3 ________________________________;
③NH4NO3 ________________________。
(3)按要求写出下列方程式:
①写出硫酸铜溶液中滴加氢氧化钠溶液的反应的离子方程式:_____________。
②写出能用离子方程式CO32-+2H+=CO2↑+H2O表示的一个化学方程式:__________。
【答案】②③⑤⑥⑧ ④⑨ ①⑦⑧⑩ NaHSO4=Na++H++SO42- Al2(SO4)3=2Al3++3SO42- NH4NO3=NH4++NO3- Cu2++2OH-==Cu(OH)2↓ Na2CO3+2HCl=2NaCl+CO2↑+H2O(或其他)
【解析】
(1)在水溶液里或熔化状态下能够自身电离出离子的化合物是电解质,属于电解质的是NaCl晶体、NaHSO4、CaO、HCl、熔融Ba(OH)2,答案选②③⑤⑥⑧;在水溶液里和熔融状态下都不能自身电离出离子的化合物是非电解质,属于非电解质的是CO2、C2H5OH,答案选④⑨;含有自由移动电子或离子的物质可以导电,能导电的是Cu、稀H2SO4、熔融Ba(OH)2、NaCl溶液,答案选①⑦⑧⑩;(2)①NaHSO4在水溶液中的电离方程式为NaHSO4=Na++H++SO42-;②Al2(SO4)3在水溶液中的电离方程式为Al2(SO4)3=2Al3++3SO42-;③NH4NO3在水溶液中的电离方程式为NH4NO3=NH4++NO3-。(3)①硫酸铜溶液中滴加氢氧化钠溶液生成氢氧化铜沉淀和硫酸钠,反应的离子方程式为Cu2++2OH-==Cu(OH)2↓:②能用离子方程式CO32-+2H+=CO2↑+H2O表示的一个化学方程式可以是Na2CO3+2HCl=2NaCl+CO2↑+H2O。
点睛:化合物在水溶液中或受热熔化时本身能否发生电离是区别电解质与非电解质的理论依据,能否导电则是实验依据。因此能导电的物质不一定是电解质,如石墨;电解质本身不一定能导电,如NaCl晶体。
【题型】填空题
【结束】
27
【题目】为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。
(1)往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色A________,B____________。
(2)写出上述过程中有关反应的化学方程式:
Fe2O3→A_______________________;A→B____________________________。
(3)B→C可看到的现象是___________________________________________。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得_______________胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为___________效应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大。它们的原子最外层电子数之和为13,X的原子半径比Y的小,其中X与W同主族。一种常见的无色无味液体分解可以得到X和Z元素的单质。下列说法中错误的是
A.X、Y、Z三种元素可以形成既含共价键又含离子键的化合物
B.元素 X和 W之间不可能形成二元化合物
C.元素Z 的简单气态氢化物的热稳定性比Y的强
D.元素 Y、Z、W的简单离子中,W的离子半径最小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.二氧化锰和浓盐酸反应:MnO2+4HCl(浓)![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.氯气与氢氧化钠溶液反应Cl2+2OH-=ClO-+Cl-+H2O
C.铜和稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O
D.氯化铝和氨水反应:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)的制取原理为:Al2O3+N2+3C=2AlN+3CO↑,由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。
(1)称取20.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出NH36.72L(标准状况)。AlN与NaOH溶液反应的化学方程式为__________;该样品中的的AlN质量分数为__________。
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,AlN不跟O2反应),该样品中含杂质炭__________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com