
8.40g A
与3.65g B完全反应, 生成5.85g C和1.8g D及一种气体, 此气体的密度是相同条件下氢气密度的22倍, 则反应生成的气体在标准状况下占有的体积为[
]A
.2.24L B.11.2L C.22.4L D.1.12L 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
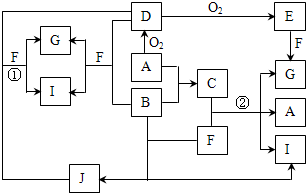
 由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.
由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.

 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通 入淀粉KI溶液 |
溶液最初变成 蓝 蓝 色 |
Cl2+2I-=2Cl-+I2 Cl2+2I-=2Cl-+I2 (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=10HCl+2HIO3 5Cl2+I2+6H2O=10HCl+2HIO3 (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三百校大联考一模考试化学试卷 题型:实验题
(12分,本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分)
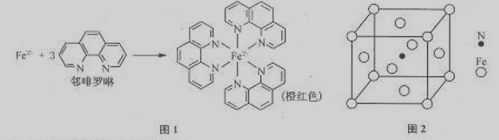
(1)Fe2+在基态时,核外电子排布式为 。
(2)羟胺(NH2OH)中采用sp3杂化的原子有 ,羟胺熔沸点较高,是因为分子间存在较强的 。
(3)Fe2+与邻啡罗啉形成的配合物(形成过程如图1)中,配位数为 。
(4)根据价层互诉理论,C1O4—空间构形为 。
(5)铁能与氮形成一种磁性材料,其晶胞结构如图2,则该磁性材料的化学式为 。
B.生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过取代反应(酯交换,生成新酯和新醇)得到,用菜籽油制备生物柴油的步骤如下:
①将三口烧瓶和锥形瓶做干燥处理,先向三口烧瓶中加入20g菜籽油,再称取40g正已烷(约61mL)。
②称取甲醇4.6g(约5.8mL)放到锥形瓶中,然后称取0.2g氢氧化钠固体并使之溶解,然后加到三口烧瓶中。
③如下图所示安装三口烧瓶。
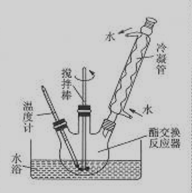
④恒温水浴加热,使温度保持在60—65℃左右,搅拌1.5—2h。
⑤停止加热后,冷却,取出三口烧瓶,静置、分液,上层
为生物紫油,正已烷和甲醇,下层主要为甘油。
⑥用温水洗涤制得的生物柴油3—4次。
⑦将水洗后的溶液倒入圆底烧瓶中,蒸馏,温度保持在
120℃左右,直至无液体蒸出后,烧瓶中剩余的液体主要即为
生物柴油。
(1)氢氧化钠的作用是 。
(2)正已烷的作用是 。
(3)图中冷凝管的作用是 。
(4)步骤⑤分液,用到的主要的一种玻璃仪器是 (写名称)
(5)确定步骤⑥已洗涤干净的方法是 。
(6)酸价(1g油酯的游离脂肪酸所需氢氧化钾的毫克数)的测定
a. 称取均匀试样Wg注入锥形瓶中,加入石油醚—乙醇混合液25mL,摇动锥形瓶使试样溶解。
b.滴入3滴酚酞,用0.100 mol/L KOH溶液滴定至出现微红色且保持30s不消失,消耗KOH溶液VmL。
则该生物柴油的酸价为 (用含W、V的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
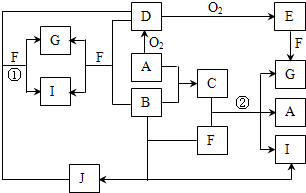 由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.
由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通 入淀粉KI溶液 | 溶液最初变成______色 | ______ (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | ______ (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通 入淀粉KI溶液 |
溶液最初变成______色 | ______ (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | ______ (用化学方程式表示) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com