
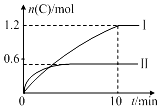
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1实验内容和结果分别如表和图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1实验内容和结果分别如表和图所示.下列说法正确的是( )| 实验序号 | 温度 | 起始物质的量 | 热量变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 0.5 mol | 1.5 mol | -- |
| A. | a=160 | |
| B. | 600℃时,该反应的平衡常数是0.45 | |
| C. | 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol•L-1•min-1 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率不变 |
分析 A.根据图象中的变化量结合图表中热量变化计算,依据化学平衡三段式可知,
A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,
起始量(mol) 1 3 0 0 akJ
变化量(mol) 0.6 0.6 1.2 0.6 96kJ
平衡量(mol) 0.4 2.4 1.2 0.6
反应焓变是指1molA全部反应的热量变化;
B.结合B中化学平衡三段式列式计算平衡浓度,c(A)=0.2mol/L,c(B)=1.2mol/L,c(C)=0.6mol/L,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
C.图象分析可知实验Ⅰ中,10 min内C生成了1.2mol,结合化学反应速率v=$\frac{△c}{△t}$计算,速率之比等于化学方程式计量数之比,以此计算B的反应速率;
D.反根据等效平衡分析判断,反应前后气体体积不变,等比等效分析.
解答 解:图象分析,先拐先平温度高,温度越高C物质的量越小,温度升高,平衡逆向进行,说明反应是放热反应,
A.由化学平衡三段式可知,
A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,
起始量(mol) 1 3 0 0 akJ
变化量(mol) 0.6 0.6 1.2 0.6 96kJ
平衡量(mol) 0.4 2.4 1.2 0.6
反应焓变是指1molA全部反应的热量变化,则a=$\frac{96kJ}{0.6mol}$=160kJ/mol
图象分析,先拐先平温度高,温度越高C物质的量越小,温度升高,平衡逆向进行,说明反应是放热反应,所以a=-160kJ/mol,故A错误;
B.由B中可知平衡浓度:c(A)=0.2mol/L,c(B)=1.2mol/L,c(C)=0.6mol/L,平衡常数K=$\frac{0.{6}^{2}}{0.2×1.2}$=1.5,故B错误
C.10 min内C生成了1.2mol,则反应速率v(C)=$\frac{\frac{1.2mol}{2L}}{10min}$=0.06mol/L•min,速率之比等于化学方程式计量数之比,v(B)=$\frac{1}{2}$v(C)=0.06mol/L•min×$\frac{1}{2}$=0.03mol/L•min,故C错误;
D.反应前后气体体积不变,等比等效,开始投入量 AB之比为3:1,向实验Ⅱ的平衡体系中再充1.5 mol A和0.5 mol B,可以看作先投入0.5 mol A和1.5 mol B后再投入0.5 mol A和1.5 mol B,两个平衡为等效平衡,则A的转化率不变,故D正确;
故选D.
点评 本题考查化学平衡计算,涉及图象的理解判断、平衡常数、反应速率、等效平衡的计算与分析应用,明确化学平衡及其影响为解答关键,D为易错点,注意掌握等效平衡的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
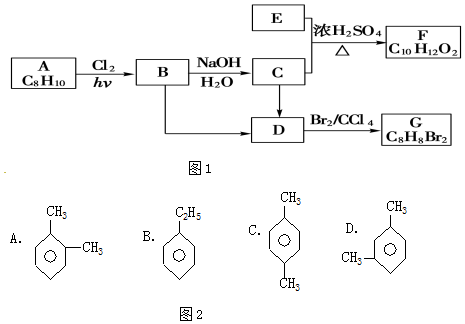
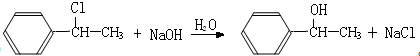 ;
; ;
;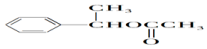 ;
; (结构简式).
(结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入酚酞呈红色的溶液中:CO32-、NH4+、NO3-、K+ | |
| B. | 含有大量NO3-的溶液中:H+、Na+、Fe2+、Cl- | |
| C. | 强酸性溶液中:Fe3+、NH4+、Cl-、SCN- | |
| D. | 含有NaHSO4的溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O?NH4++OH- | B. | CH3COOH?CH3COO-+H+ | ||
| C. | NaHCO3=Na++H++CO32- | D. | AlCl3=Al3++3Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
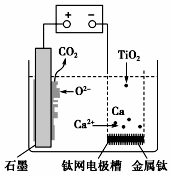 研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )| A. | 在制备金属钛前后,整套装置中CaO的总量保持不变 | |
| B. | 阳极的电极反应式为C+2O2--4e-═CO2↑ | |
| C. | 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol 电子 | |
| D. | 若用铅蓄电池作供电电源,“-”接线柱应连接Pb电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| B. | 室温下,氯化铵溶液显酸性的理由:NH4++H2O═NH3•H2O+H+ | |
| C. | 泡沫灭火器的反应原理:Al3++3HCO3-═3CO2↑+Al(OH)3↓ | |
| D. | 用铜作电极电解饱和食盐水:2Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以利用铝热反应冶炼高熔点的金属 | |
| B. | 现代石油化工,采作银作催化剂可以实现一步完成乙烯转化为环氧乙烷的过程,该反应的原子利用率为100% | |
| C. | 工业上制溴是向酸化的浓缩海水中直接通入氯气置换出溴即可 | |
| D. | 煤直接液化可得液体燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com