解答:解:(1)①CH
4是正四面体结构,②C
2H
4是平面形分子 ③C
2H
2是直线形分子 ④NH
3是三角锥形分子,⑤NH
是正四面体结构,⑥BF
3是平面三角形分子 ⑦P
4是正四面体结构,⑧H
2O是V形分子⑨H
2O
2的空间构型是二面角结构,两个H原子犹如在半展开的书的两面纸上并有一定夹角;
故答案为:①④⑦;
(2)①CH
4中C原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp
3杂化,
②C
2H
4中C原子杂化轨道数=δ键数+孤对电子对数=3+0=3,所以采取sp
2杂化,
③C
2H
2中C原子杂化轨道数=δ键数+孤对电子对数=2+0=2,所以采取sp杂化,
④NH
3中氮原子杂化轨道数=δ键数+孤对电子对数=3+1=4,所以采取sp
3杂化;
⑤NH
4+中氮原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp
3杂化;
⑥BF
3中B原子杂化轨道数=δ键数+孤对电子对数=3+0=3,所以采取sp
2杂化,
⑦P
4中P原子杂化轨道数=δ键数+孤对电子对数=3+1=4,所以采取sp
3杂化;
⑧H
2O中O原子杂化轨道数=δ键数+孤对电子对数=2+2=4,所以采取sp
3杂化;
⑨H
2O
2中O原子杂化轨道数=δ键数+孤对电子对数=2+2=4,所以采取sp
3杂化;
所以中心原子轨道为sp
2杂化的是②⑥;为sp杂化的是③;
故答案为:②⑥;③;
(3)②C
2H
4是平面形分子,所有原子共平面而不共线;
③C
2H
2是直线形分子,所有原子共平面也共线;
⑥BF
3是平面三角形分子,所有原子共平面而不共线;
⑧H
2O是V形分子,所有原子共平面而不共线;
故答案为:②⑥⑧;
(4)NH
4+中N提供孤电子对,H
+提供空轨道,二者都能形成配位键,其余都不能形成配位键;
故答案为:⑤;
(5)①CH
4分子中含有碳氢极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;
②C
2H
4分子中含有碳氢极性键,碳碳非极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;
③C
2H
2分子中含有碳氢极性键,碳碳非极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;
④NH
3分子中含有氮氢极性键,电荷的分布是不均匀的,不对称,为极性分子;
⑤NH
4+不是分子;
⑥BF
3分子中含有硼氢极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;
⑦P
4分子中含有磷磷极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;
⑧H
2O分子中含有氢氧极性键,电荷的分布是不均匀的,不对称,为极性分子;
⑨H
2O
2分子中含有氢氧极性键,氧氧极性键,电荷的分布是不均匀的,不对称,为极性分子;
所以含有非极性键的极性分子是⑨;
故选:⑨;
(6)①CH
4的核外电子数=6+1×4=10;
②C
2H
4的核外电子数=6×2+1×4=16;
③C
2H
2的核外电子数=6×2+1×2=14;
④NH
3的核外电子数=7+1×3=10;
⑤NH
4+不是分子;
⑥BF
3的核外电子数=5+9×3=32;
⑦P
4的核外电子数=15×4=60;
⑧H
2O的核外电子数=8+1×2=10;
⑨H
2O
2的核外电子数=8×2+1×2=18;
故答案为:⑨;
(7)①CH
4 ⑤NH
4+的原子数都为5,核外电子数分别为10、10,属于等电子体,
故答案为:①、⑤.



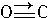 ,与CO结构最相似的分子是
,与CO结构最相似的分子是