
| A. | 30% | B. | 40% | C. | 60% | D. | 70% |
分析 镁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液,沉淀为氢氧化镁,则经洗涤、干燥、灼烧,得到白色粉末为氧化镁,氧化镁质量等于合金的质量,利用组成可知氧化镁中O元素的质量等于合金中Al的质量,以此来解答.
解答 解:由镁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液,沉淀为氢氧化镁,则经洗涤、干燥、灼烧,得到白色粉末为MgO,MgO的质量等于合金Mg、Al的质量,所以MgO中O元素的质量等于合金中Al的质量,即$\frac{16}{40}$×100%=40%,
故选B.
点评 本题考查混合物的有关计算,题目难度中等,明确发生的反应找出合金与氧化物的关系是解答本题的关键,试题侧重考查学生的分析、理解能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:填空题
某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:

(1)该反应的化学方程式为 。
(2)反应开始至2 min,用Y表示的平均反应速率为 ,X的转化率为 。
(3)在密闭容器里,通入a mol A(g)和b mol B(g),发生反应A(g)+ B(g)= 2C(g),当改变下列条件时,会加快反应速率的是 (填序号)。
①降低温度 ②保持容器的体积不变,充入氦气
③加入催化剂 ④保持容器的体积不变,增加A(g)的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b=c | B. | b>a>c | C. | b>c>a | D. | b=c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5Cl2+I2+6H2O═10HCl+2HIO3 | |
| B. | 2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)+2H2O | |
| C. | MnO2+4HCI$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ | |
| D. | 2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH++Cl2↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
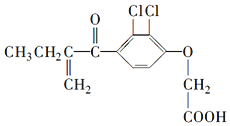
| A. | 利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4 | |
| B. | 利尿酸分子内处于同一平面的原子不超过10个 | |
| C. | 1mol利尿酸能与7mol H2发生加成反应 | |
| D. | 利尿酸能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
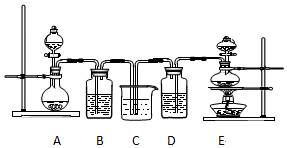

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
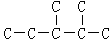 ,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH
,此烷烃的一溴代物有6种;若此烷烃由炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com