
| A. | 氢化物稳定性:CH4<NH3<H2O | B. | 第一电离能:C<N<O | ||
| C. | 电负性:C<N<O | D. | 氢化物沸点:CH4<NH3<H2O |
分析 A.非金属性越强,对应氢化物越稳定;
B.非金属性越强,第一电离能越大,且N的2p电子半满为稳定结构;
C.非金属性越强,电负性越大;
D.NH3、H2O均含氢键沸点高,且水中氢键多.
解答 解:A.非金属性C<N<O,对应氢化物稳定性:CH4<NH3<H2O,故A正确;
B.非金属性越强,第一电离能越大,且N的2p电子半满为稳定结构,则第一电离能:C<O<N,故B错误;
C.非金属性C<N<O,则电负性为C<N<O,故C正确;
D.NH3、H2O均含氢键沸点高,且水中氢键多,则氢化物沸点:CH4<NH3<H2O,故D正确;
故选B.
点评 本题考查元素周期律和周期表的应用,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):用NaOH溶液洗涤后分液 | |
| B. | 乙烷(乙烯):用溴水洗气 | |
| C. | 溴苯(溴):用NaOH溶液洗涤后分液 | |
| D. | 乙醇(水):用生石灰吸水后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
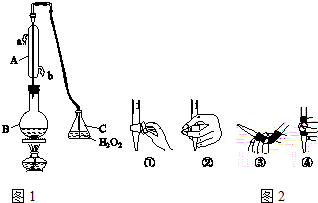
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>HClO4 | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Cu为负极,Zn为正极 | B. | 电子从铜片经外电路流向锌片 | ||
| C. | 负极反应为:Zn-2e-═Zn2+ | D. | 该装置将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
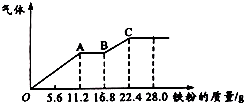 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 混合酸中H2SO4浓度为4 mol•L-1 | |
| B. | 200mL混合酸中NO3-物质的量为0.2mol | |
| C. | AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | |
| D. | 加入铜粉的那份混合酸,反应后剩余0.1mol H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定只含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 仅含有共价键的化合物一定是共价化合物 | |
| D. | 由不同种非金属元素的原子形成的共价化合物一定只含极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com