
| A、一定含Mg2+、Al3+、Cl-,不含Na+、NH4+ |
| B、一定含Na+、Mg2+、Cl-,不含NH4+,可能含有Al3+ |
| C、c(Cl-)为4.0mol/L,c(Al3+)为1.0mol/L |
| D、c(Mg2+)为1.0mol/L,c(Na+)为0.5mol/L |
| 11.48 |
| 143.5g/mol |
| 0.01mol |
| 0.02L |
| 0.08mol |
| 0.02L |
| 0.02mol |
| 0.02L |
| 0.01mol |
| 0.02L |


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
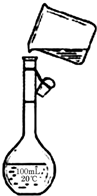 用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空:
用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | F | Ne | |||||
| 3 | Na | Mg | Al | Si | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
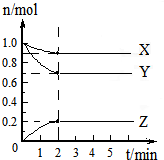 (一)某可逆反应:2A(g)?B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
(一)某可逆反应:2A(g)?B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:| 验序号 | 时间/min 浓度/mol?L-1 温度/℃ |
0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 | |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、24.4g |
| B、13.2g |
| C、12.5g |
| D、11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
 | 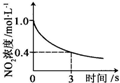 | 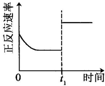 | 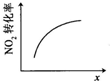 |
| 升高温度,平衡常数减小 | 0-3s内,反应速率为:v(NO2)=0.2 mol?L-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na和K | B、Mg和Al |
| C、Cu和Al | D、Al和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H1>0,△H3<0 |
| B、△H2>0,△H4>0 |
| C、△H1=△H2+△H3 |
| D、△H3=△H4+△H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
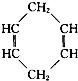 可简写为
可简写为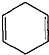 .现有某化合物W的分子结构可表示为
.现有某化合物W的分子结构可表示为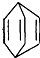 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com