

图6-2
回答下面问题:
(1)为什么关闭弹簧夹时试管中液面会下降?
(2)这种制气装置在加入反应物前,怎样检查装置的气密性?
(3)从下面三个反应中选择一个可以用这种随制随停的制气装置制取的气体,填写下表中的空白。
①大理石与盐酸反应制取二氧化碳
②黄铁矿与盐酸反应制取硫化氢
③用二氧化锰催化分解过氧化氢制氧气
气体名称 | 收集方法 | 检验方法 |
|
|
|
(4)食盐跟浓硫酸反应制氯化氢不能用这种装置随制随停。试说明理由。
科目:高中化学 来源: 题型:
NaBr+H2SO4![]() NaHSO4+HBr
NaHSO4+HBr
CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
已知反应物的用量,NaBr(固体)0.3 mol,乙醇0.25mol,浓硫酸36 mL(98%,密度

图6-2
(1)仅用图6-2所示仪器安装制取和收集溴乙烷的装置,要求达到安全、损失少、不污染环境的目的,有关仪器的选择和连接顺序为(填数字)____________。
(2)写出不能选用的仪器(填仪器代码,如甲、乙……)及理由。
不能选用的仪器 | 理由 |
|
|
|
|
|
|
(3)反应时,若温度过高,可见有棕色气体产生,写出反应的化学方程式:_________。
(4)从棕黄色的粗溴乙烷制取无色的溴乙烷,应加入的试剂是_________,必须使用的仪器是_________。
(5)本实验的产率为60%,则可制取溴乙烷_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:

图6-5
请完成下列问题:?
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是: 。?
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。?
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:?
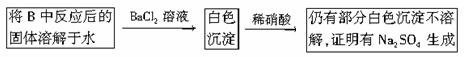 ?
?
上述方案是否合理? 。请简要说明两点理由:??
①; ② 。??
查看答案和解析>>
科目:高中化学 来源: 题型:
溴乙烷是一种难溶于水的无色液体,密度约为水的1.5倍,沸点为38.4 ℃。实验室制取溴乙烷的反应如下:
NaBr+H2SO4![]() NaHSO4+HBr
NaHSO4+HBr
CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
已知反应物的用量,NaBr(固体)0.3 mol,乙醇0.25mol,浓硫酸36 mL(98%,密度1.84 g·cm-3),水25 mL,其中乙醇的密度约为水的密度的4/5。试回答:

图6-2
(1)仅用图6-2所示仪器安装制取和收集溴乙烷的装置,要求达到安全、损失少、不污染环境的目的,有关仪器的选择和连接顺序为(填数字)____________。
(2)写出不能选用的仪器(填仪器代码,如甲、乙……)及理由。
| 不能选用的仪器 | 理由 |
(3)反应时,若温度过高,可见有棕色气体产生,写出反应的化学方程式:_________。
(4)从棕黄色的粗溴乙烷制取无色的溴乙烷,应加入的试剂是_________,必须使用的仪器是_________。
(5)本实验的产率为60%,则可制取溴乙烷_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:

图6-10
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:将_________,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管要插在饱和Na2CO3溶液的液面上,不能插入溶液中,目的是防止Na2CO3溶液的倒吸。造成倒吸的操作上的原因是__________________。
(3)浓硫酸的作用是:①__________________;②__________________。
(4)饱和Na2CO3溶液的作用是__________________。
(5)实验生成的乙酸乙酯,其密度比水_________ (填“大”或“小”),有_________气味。
(6)若实验中温度过高,使反应温度达到
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com