
| A、0.1mol/L (NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=4的醋酸稀释l0倍,溶液中c(CH3COOH)、c(OH-)均减小 |
| C、常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)=c(CH3COO-) |
| D、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
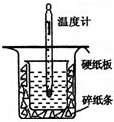 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题| 实验序号[来源:学#科#网] | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
| 3 | 25.1 | 25.1 | 25.1 | 27.1 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+43.5 kJ/mol |
| B、-67.7 kJ/mol |
| C、+67.7 kJ/mol |
| D、-43.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.96g |
| B、4.68g |
| C、2.15g |
| D、3.78g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| t/s | 0 | 500 | 1 000 |
| c(H2)/(mol?L-1) | 5.00 | 3.52 | 2.48 |
| c (CO)/(mol?L-1) | 2.50 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
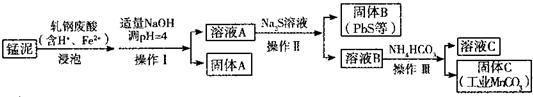
| c(Ca2+) |
| c(Mn2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、X、Y、Z三种元素中,Y的非金属性最强 |
| B、Y的氢化物的稳定性比Z的氢化物强 |
| C、Z的最高正化合价为+6 |
| D、常压下Z的单质的熔点比Y的低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫的水溶液能使紫色石蕊试液变红,说明它能和水反应生成H2SO3 |
| B、二氧化硫能漂白某些物质,说明它具有氧化性 |
| C、将足量二氧化硫通入酸性高锰酸钾试液中,溶液褪色,说明二氧化硫具有还原性 |
| D、实验室可用浓硫酸干燥二氧化硫气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com