
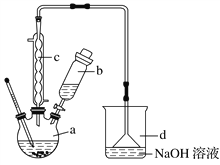
����Ŀ���屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й��������£�
�� | �� | �屽 | |
�ܶ�/g��cm��3 | 0.88 | 3.10 | 1.50 |
�е�/�� | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |
�����кϳɲ���ش����⣺
��1����a�м���15 mL��ˮ����������м����b��С�ļ���4.0 mLҺ̬�塣��a�е��뼸���壬�а�ɫ��������������Ϊ������________���壻�����μ���Һ����ꣻװ��d��������________________��
��2��Һ�����������в�������ᴿ��
����a�м���10 mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10 mLˮ��8 mL 10%��NaOH��Һ��10 mLˮϴ�ӡ�NaOH��Һϴ�ӵ�������_______________________________________________________��
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˡ������Ȼ��Ƶ�Ŀ����____________________________________________ ��
��3�������Ϸ���������屽�л����е���Ҫ����Ϊ______��Ҫ��һ���ᴿ�����в����п��е���________(����ĸ)��
A.�ؽᾧ B.����
C.���� D.��ȡ
��4���ڸ�ʵ���У�a���ݻ����ʺϵ���________(����ĸ)��
A.25 mL B.50 mL
C.250 mL D.500 mL
���𰸡� HBr ����HBr��Br2 ��ȥHBr��δ��Ӧ��Br2 ���� �� C B
��������(1)��м��������a�з����ķ�ӦΪ![]() ��Br2
��Br2![]()
 ��HBr��HBr������ˮ���������������װ��d�������ǽ���β������������HBr�ͻӷ�������������(2)��δ��Ӧ��Br2�������屽�У���Ϊ���ʣ�Br2��ˮ�е��ܽ�Ƚ�С��������NaOH��Һ��Ӧ���ַ�Ӧ���ɵ�HBr��������ˮ���屽����ḽ���������ᣬ��NaOH��Һϴ�ӵ������dz�ȥHBr��δ��Ӧ��Br2�����ֳ��Ĵ��屽�л���ˮ�֣����������Ȼ��ƿ��Գ�ȥˮ�֡�(3)�����屽���ܣ��������������û�г�ȥ�����Լ������Ծ��������������屽�е���Ҫ�����DZ������ݱ����屽�ķе��нϴ���죬������ķ������Խ����߷��롣(4)4.0 mLҺ��ȫ������a�����У���a������Һ������ԼΪ19 mL�����ǵ���ӦʱҺ����ܻ���ڣ�Һ��������ܳ���������
��HBr��HBr������ˮ���������������װ��d�������ǽ���β������������HBr�ͻӷ�������������(2)��δ��Ӧ��Br2�������屽�У���Ϊ���ʣ�Br2��ˮ�е��ܽ�Ƚ�С��������NaOH��Һ��Ӧ���ַ�Ӧ���ɵ�HBr��������ˮ���屽����ḽ���������ᣬ��NaOH��Һϴ�ӵ������dz�ȥHBr��δ��Ӧ��Br2�����ֳ��Ĵ��屽�л���ˮ�֣����������Ȼ��ƿ��Գ�ȥˮ�֡�(3)�����屽���ܣ��������������û�г�ȥ�����Լ������Ծ��������������屽�е���Ҫ�����DZ������ݱ����屽�ķе��нϴ���죬������ķ������Խ����߷��롣(4)4.0 mLҺ��ȫ������a�����У���a������Һ������ԼΪ19 mL�����ǵ���ӦʱҺ����ܻ���ڣ�Һ��������ܳ���������![]() ����ѡ��50 mL����Ϊ�ˡ�
����ѡ��50 mL����Ϊ�ˡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
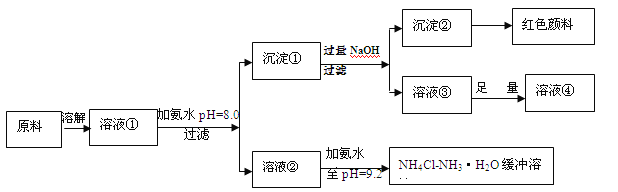
����Ŀ��(14��)ij��ҵԭ����Ҫ�ɷ���NH4Cl��FeCl3��AlCl3�����ô�ԭ�Ͽ��Եõ����ֹ�ҵ��Ʒ�������������̣��ش����⡣
��֪��Ksp[Fe(OH)3]=4.0��10-38
��1����ϡ�����к͵������pHֵ�İ�ˮ���ռ���Һ��ǰ����Ҫ���ĵ���Һ��� �����С������ͬ����
��2��������Һ����Fe3�������ʵ���Ũ��Ϊ mol/L
��3��������Һ�д��ڵ�ƽ����ϵ�У� �� ��
��ʱ��Һ��c(NH4��) c(Cl-)(��>��=��<)��
��4���ڻ�����Һ�м��������������NaOH��Һ����Һ��pHֵ������ȻΪ9.2������ԭ����
��ٳ���һ�ֻ�����Һ������(д��ѧʽ) ��
��5�����������Ũ����Һ���в���ͨ��HCl���壬����������AlCl3��6H2O���壬��ϻ�ѧƽ���ƶ�ԭ���������������ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
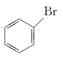
����Ŀ��ij�л��ϳ��м���Ľṹ��ʽ��ͼ��ʾ�����й��ڸ��л������������ȷ����

A. ����ʽΪC9H9O4Br
B. ��һ�������¿���HCHO�������۷�Ӧ
C. 1 mol������������NaOH��Һ��ϼ��ȣ����������4mol NaOH
D. 1 mol��������Ũ��ˮ��Ӧ�����������3mol Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����(����)
A. ��ͭ����ϡ�����У�Cu+4H++2NO3�C===Cu2++2NO2��+H2O
B. ��̼�������Һ�м�����������ʯ��ˮ��Ca2++![]() +OH�C
+OH�C![]() CaCO3��+H2O
CaCO3��+H2O
C. ��Al2(SO4)3��Һ�м��������ˮ��Al3++3NH3��H2O===Al(OH)3��+3NH4+
D. ��Na2SiO3��Һ�еμ�ϡ���Na2SiO3+2H+===H2SiO3��+2Na+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������뻯ѧ�����йص�˵����ȷ���ǣ�������
A.���Ϸ�Ӧ��Ϊ������ԭ��Ӧ
B.���������������������
C.�ռ�����ʯ�Ҷ��Ǽ�
D.BaSO4��NaOH��HNO3����ǿ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����Ȼ�ѧ����ʽ�У���ѧ��Ӧ����Hǰ�ߴ��ں��ߵ���(����)
��C(s)��O2(g)===CO2(g)����H1 C(s)��1/2O2(g)===CO(g)����H2
��S(s)��O2(g)===SO2(g)����H3 S(g)��O2(g)===SO2(g)����H4
��H2(g)��1/2O2(g)===H2O(l)����H5 2H2(g)��O2(g)===2H2O(l)����H6
��CaCO3(s)===CaO(s)��CO2(g)����H7 CaO(s)��H2O(l)===Ca(OH)2(s)����H8
A���� B���� C���ڢۢ� D���٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ꡢ�����ն����⻯ѧ�����Ȼ����������Ҫԭ��֮һ���������������Ⱦ���е��������ѳ�Ϊ���ǹ�ע����Ҫ����֮һ��
I.NH3-SCR���ǹ�ҵ��������������ij��÷������÷������ð��Ļ�ԭ�ԣ���һ�������£��������е�NOxֱ�ӻ�ԭΪN2��
��Ҫ��Ӧԭ��Ϊ��4NH3+4NO+O2![]() 4N2+6H2O
4N2+6H2O
��1����֪�������Ȼ�ѧ����ʽ��
��4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(1) ��H =-1891.5kJmol-1
4N2(g)+6H2O(1) ��H =-1891.5kJmol-1
��N2(g)+O2(g)![]() 2NO(g) ��H =+180.5kJmol-1
2NO(g) ��H =+180.5kJmol-1
��H2O(1)=H2O(g) ��H =+44.0kJmol-1
������������Ӧ����NO����̬ˮ���Ȼ�ѧ����ʽΪ_________________________________��
��2������������ͬ��ij2 L�ܱ������зֱ�Ͷ��2 mol NH3��2 mol NO��1 mol O2���ڼס������ִ��������£�NOת�������¶ȵĹ�ϵ��ͼ��ʾ��
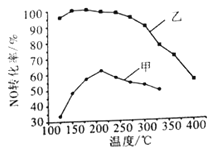
�ٹ�ҵ��ѡ������ҵ�ԭ����_________________��
���ڴ����������£�����210��ʱ��NOת���ʽ��͵�ԭ�������_______________________��
��.CH4�������������������Ⱦ����Ҫ��Ӧԭ��Ϊ��CH4(g)+2NO2(g)= CO2(g)+2H2O(g)+ N2(g) ��H=-868.7kJmol-1
��3����3.00L�ܱ������У�ͨ��0.100mol CH4��0.200mol NO2����һ���¶��½���������Ӧ����Ӧʱ��(t)��������������ѹǿ(P) �����ݼ��±���
��Ӧʱ��t/min | 0 | 2 | 4 | 6 | 8 | 10 |
��ѹǿP/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
�ɱ������ݣ�����0-4min��v(NO2)=____________�����¶��µ�ƽ�ⳣ��K=________________��
��4����һ����װ���У�ͨ��һ����CH4��NO2���������ͬʱ���ںͲ�ͬ�¶��£�NO2��ת������(NO2)����ͼ��������������ȷ����_____________
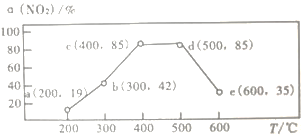
A.���¶�ά����200�����ʱ�䣬NO2��ת���ʽ�����19%
B.��Ӧ���ʣ�b���v(��)>e���v(��)
C.ƽ�ⳣ���� c��=d��
D.��ʱ��t�ڣ����c��ʱNO2��ת���ʺͷ�Ӧ���ʣ����ʵ����»�����c(CH4)
��.��ҵ��Ҳ�����õ��ķ������������������Ⱦ��
��5���廪��ѧ����������о��Ļ��ڹ������������(SOEC)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�������Һ�д���������ǣ�������
A.Na+��Cu2+��Cl����OH��
B.H+��Ca2+��HCO3����NO3��
C.Fe2+��H+��SO42����NO3��
D.Na+��CO32����OH����K+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֶ�����Ԫ����ɵĵ���a��b��c�����Ԫ������X��Y��Z������֮���ת����ϵ��ͼ��ʾ����֪:X��a��bԪ�ص�ԭ�Ӹ�����Ϊ1:1��������L��һ����ɫ����״Һ�塣����˵������ȷ����
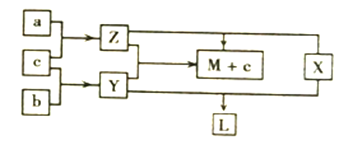
A. b��c������������Ԫ������ͬ����Ԫ�� B. X��Y��Z������һ�������м��Թ��ۼ�
C. L��Y��Z��������������֮�������Ӧ D. ͬ��ͬŨ�ȵ�ˮ��Һ������ǿ��Ϊ:L>Y>Z
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com