
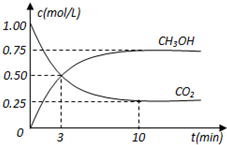
 在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示.
在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示.分析 (1)由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,根据浓度变化量之比等于化学计量数之比氢气的浓度变化量,根据v=$\frac{△c}{△t}$计算v(H2);
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,根据此计算求解;
(3)平衡时正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,由此分析解答.
解答 解:(1)由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L•min),
故答案为:0.225;
(2)反应前氢气的浓度是3mol/L,所以平衡时氢气的浓度是3mol/L-2.25mol/L=0.75mol/L,则该反应的平衡常数K=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=5.33,故答案为:5.33;
(3)a.容器中压强保持不变,说明气体的物质的量不变,反应达平衡状态,故正确;
b.混合气体密度保持一直不变,故错误;
c.容器内CO2的分子数保持不变,说明各物质的量不变,反应达平衡状态,故正确;
d.每消耗1mol CO2的同时生成1mol H2O,都反映正反应方向,故错误;
故选ac.
点评 本题考查反应速率计算、化学平衡常数的计算和化学平衡状态的判断等,难度中等,注意基础知识的掌握,平衡常数表达式中的浓度为平衡浓度.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| 命名 | 一氯代物 | |
| A | 2-甲基-2-乙基丙烷 | 3 |
| B | 1,3-二甲基苯 | 3 |
| C | 2,2,3-三甲基戊烷 | 6 |
| D | 2,3-二甲基-4-乙基己烷 | 7 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与CO2反应 | B. | 铝片与稀H2SO4反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl的反应 | D. | 甲烷在O2中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应 | 测量依据(单位时间内) |
| A | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
| B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
| C | 2NO2?N2O4 | 颜色深浅 |
| D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在SiO2晶体中,1个Si原子和2个O原子形成两条共价键 | |
| B. | 由多种非金属元素组成的化合物一定是共价化合物 | |
| C. | HF、HCl、HBr、HI四种物质的沸点依次升高 | |
| D. | 晶体熔化时化学键不一定发生断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H3PO4的质量为98g.mol-1 | B. | H3PO4的摩尔质量为98 g | ||
| C. | 9.8 g H3PO4含有NA个H3PO4分子? | D. | NA个H3PO4分子的质量为98g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 | 实验结论 |
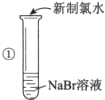 | 溶液变为黄色 | 氧化性:Cl2>Br2 |
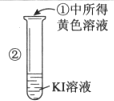 | 溶液变为黄色 | 氧化性: Br2>I2 |
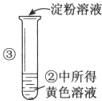 | 溶液的颜色由黄色变为蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com