
| A、向50 mL 1mol?L-1的盐酸中加入烧碱后,水的Kw不变 | ||
| B、NH4C1和NH3?H2O混合液中,二者对对方的平衡都起了抑制作用 | ||
| C、室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐 | ||
D、常温下0.1 mol?L-1的HA溶液中
|
| c(OH-) |
| c(H+) |
| c(OH-) |
| c(H+) |


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
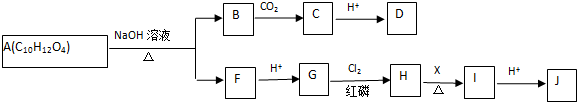
| Cl2 |
| 红磷 |
 +HCl
+HCl查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①③④ |
| C、①②④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.l mol的2H35Cl分子中的中子数是2NA |
| B、标准状况下,一定量的铜与硝酸反应后生成22.4 LNO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA |
| C、100mL 1 mol Na[Al(OH)4]溶液中含有0.12NA个[Al(OH)4]- |
| D、1mol羟基和1mol氢氧根离子中的电子数和质子数均相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应过程中,电子转移数为2NA |
| B、固体生成物的质量为106g |
| C、CO可能有剩余 |
| D、反应后一定生成11.2升氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | ||
| B、已知某温度下:Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.2×-12,所以该温度下AgCl的溶解度大于Ag2CrO | ||
C、室温下,将浓度为0.1mol/LHF溶液加水稀释,其电离平衡常数和
| ||
| D、反应3NO2(g)+H2O═2HNO3+NO在室温下可自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入NaOH |
| B、加入CH3COOH |
| C、加入NaCl |
| D、升温 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com