
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】乙烯的产量是衡量一个国家石油化工发展水平的重要标志。
I.将8.96L (标准状况)乙烯和乙烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应,溴的四氯化碳溶液的质量增加8.4g,则原气体混合物中乙烯与乙烷的物质的量之比为______________。
II.已知乙烯能发生以下转化:
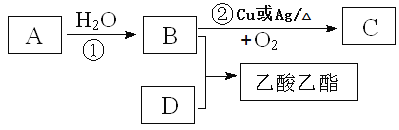
⑴写出B、D化合物中官能团的名称:B____________________;D___________________;
⑵写出相关反应的化学方程式:
①_________________________________ 反应类型:________________
②__________________________________ 反应类型:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯酚的叙述中,正确的是 ( )
A.纯净的苯酚是粉红色晶体B.苯酚不溶于水
C.苯比苯酚容易发生苯环上的取代反应D.可用浓溴水鉴别苯和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源;乙是利用装置甲模拟工业电解法来处理含Cr2O72-废水,电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。当电池工作时,下列说法错误的是

A. 甲中H+透过质子交换膜由左向右移动
B. 乙池中Fe棒应与甲池中的M极相连
C. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-=2CO2↑+N2↑+16H+
D. 若溶液中减少了0.OlmolCr2O72-,则电路中至少转移了0.06 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]氢、氮、氧、铁、铜等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)写出基态铜原子的价电子排布式__________________
(2)和铜在同一周期中,基态原子未成对电子数为2的元素共有______种。
(3)NH4HF2中HF2-的结构为F-H.......F-,则NH4HF2中含有的化学键有_________
(A)离子键 (B)共价键 (C)金属键 (D)氢键 (E)配位键
(4)写出与NH4+互为等电子体的一种分子和一种离子的化学式_______、_______;
(5)CH3OH分子中C原子的杂化方式为_______,O原子的杂化方式为_______,
键角:H-C-H_______H-O-C。(填“<”、“>”、“=”)
(6)Cu与Cl形成某种化合物的晶胞如下图所示,Cu的配位数是________,该晶体的密度为ρg·cm-3,晶胞边长为acm,则阿伏加德罗常数为__________(用含ρ、a的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(OH-)
)>c(OH-)
B. 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH![]() )+c(OH-)
)+c(OH-)
D. 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中: c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NaHCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。

如果此方案正确,那么:
(1)操作④为________,操作①、④、⑤都用到的玻璃仪器有____________。
(2)操作②为什么不用硝酸钡溶液,其理由是___________________________________。
(3)进行操作②后,如何判断SO42-已除尽,方法是_______________________________。
(4)操作③的目的是____________,为什么不先过滤后加碳酸钠溶液?理由是____________。
(5)操作⑤的目的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S与CO2高温下发生反应:H2S(g)+CO2(g) ![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 molH2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)H2S的平衡转化率α1=________%,反应平衡常数K=___________________。
(2)在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2________α1,该反应的ΔH____0(填“>”“<”或“=”)。
(3)向反应器中再分别充入下列气体,能使H2S转化率增大的是______(填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com