
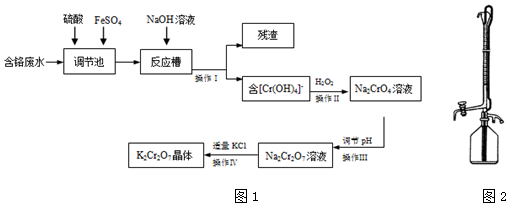
分析 含铬废水(Cr2O72-和Cr3+)加入硫酸和硫酸亚铁,进入调节池发生氧化还原反应产生铁离子和铬离子,加入氢氧化钠溶液过滤得到滤渣为氢氧化铁沉淀,滤液含Cr(OH)4-,加入过氧化氢酸性溶液中氧化Cr(OH)4-,生成Na2CrO4,操作Ⅲ调节溶液PH,使反应2CrO42-+2H+?Cr2O72-+H2O向正方向移动,酸溶液应选择硫酸,盐酸易被氧化所以不选择盐酸,得到的Na2Cr2O7溶液,加入适量KCl过滤得到K2Cr2O7晶体,据此解答.
解答 解:含铬废水(Cr2O72-和Cr3+)加入硫酸和硫酸亚铁,进入调节池发生氧化还原反应产生铁离子和铬离子,加入氢氧化钠溶液过滤得到滤渣为氢氧化铁沉淀,滤液含Cr(OH)4-,加入过氧化氢酸性溶液中氧化Cr(OH)4-,生成Na2CrO4,操作Ⅲ调节溶液PH,使反应2CrO42-+2H+?Cr2O72-+H2O向正方向移动,酸溶液应选择硫酸,盐酸易被氧化所以不选择盐酸,得到的Na2Cr2O7溶液,加入适量KCl过滤得到K2Cr2O7晶体.
(1)调节池里发生的反应是酸性溶液中重铬酸跟离子氧化亚铁离子生成铁离子的反应,反应的离子方程式为:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O;
(2)分析可知,操作Ⅰ得到的残渣为氢氧化铁,化学式为:Fe(OH)3,故答案为:Fe(OH)3;
(3)根据2CrO42-+2H+?Cr2O72-+H2O,以及实验目的,应加入酸,促使平衡向正反应方向进行,石灰乳的主要成分是氢氧化钙,碳酸钠溶液呈碱性,CD都会使平衡逆向移动,故C、D错误,因为Cr2O72-具有强氧化性,能把Cl-氧化成Cl2,故选项A错误,
故答案为:B;根据2CrO42-+2H+?Cr2O72-+H2O,以及实验目的,应加入酸,促使平衡向正反应方向进行,故C、D错误;因为Cr2O72-具有强氧化性,能把Cl-氧化成Cl2,故选项A错误;
(4)①自动定零位滴定管使得测定结果更准确,操作简单,滴定时采用如图2所示的侧边自动定零位滴定管,具有的优点是:操作简单,无视力误差,计算精确,
故答案为:操作简单,无视力误差,计算精确;
②Cr2O72-→2Cr3+,Cr3++Y4-=CrY-
反应定量关系为:Cr2O72-→2Cr3+~2H4Y(EDTA)
n(Cr3+)=n(EDTA)=amol•L-1×b×10-3L=ab×10-3mol,
计算得到铬离子的浓度=$\frac{ab×1{0}^{-3}mol×52g/mol}{0.1L}$=0.52abg/L=520abmg/L,
故答案为:520ab.
点评 本题考查了物质分离提纯的方法和实验基本操作、滴定实验的分析和计算,主要是物质性质和化学平衡的理解应用,掌握基础是解题关键,题目难度中等.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
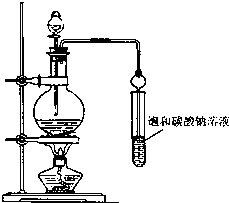 实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇和少量浓H2SO4混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,直接收集蒸馏产品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗产品.据此回答问题:
实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇和少量浓H2SO4混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,直接收集蒸馏产品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗产品.据此回答问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
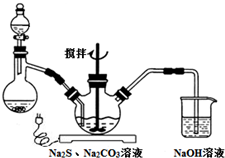 NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知乙酸和乙醇在浓硫酸催化下会发生下列反应:
已知乙酸和乙醇在浓硫酸催化下会发生下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化的元素是氯元素 | |
| B. | 氧化产物与还原产物的物质的量之比为l:1 | |
| C. | 消耗l mol还原剂,转移5 mol电子 | |
| D. | 净化1 L含CN-1.04 mg•L-1的废水,理论上需用2×l0-5mol C1O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 | |
| B. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0升高温度使平衡向逆方向移动 | |
| C. | 合成氨反应:N2(g)+3H2(g)?2NH3(g)△H<0,为使氨的产率提高,理论上应采取低温高压的措施 | |
| D. | 在溴水中存在如下平衡:Br2(g)+H2O(l)?HBr(aq)+HBrO(aq),当加入NaOH溶液后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com