
【题目】对相同物质的量的乙烯和丙烯,有下列叙述:①碳原子数之比为 2:3②氢原子数之比为 2:3③含碳的质量分数相同④分子个数之比为 1:1.其中正确的是 ( )
A.①④B.①②④C.①②③D.①②③④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(l)从1 L0.05 mol/L CuSO4溶液中取出10 mL,该10 mL溶液的物质的量浓度为____。
(2)现有下列5种物质:①CO2 ②Mg③盐酸④NaC1⑤Na2CO3。上述5 种物质中,属于电解质的有 ___。
(3)氢原子的物质的量相等的四种气体HCl、H2,、NH3、CH4,在同温同压下,此四种气体体积之比V(HCl):V(H2:V(NH3):V(CH4)=____。
(4)配制100 ml1.00 mol/L H2SO4溶液,需要用量筒量取浓硫酸(密度为1.84 g/cm3,溶质质量分数为98%)的体积为 ____保留一位小数)mL。
(5)反应![]() 中,若反应生成0.6 mol S,则反应中转移的电子为___ mol。
中,若反应生成0.6 mol S,则反应中转移的电子为___ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置在铁棒表面镀上一层铜,下列有关的判断正确的是
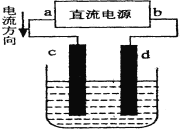
A.a为阳极、b为阴极B.c为铁棒、d为铜棒
C.电子流向从b→d→c→aD.溶液中Cu2+向d极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《天工开物》记载了“火法”冶炼锌的方法:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭)。下列说法不正确的是( )
A.煤炭中起作用的主要元素是碳
B.该冶炼锌的方法属于热还原法
C.倭铅是指金属锌和铅的混合物
D.冶炼Zn的反应方程式为ZnCO3+2C![]() Zn+3CO↑
Zn+3CO↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M、N分子的模型如图所示,其中不同颜色的球表示不同的原子,原子之间的化学键可以是单键、双键。下列说法错误的是
M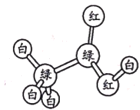 N
N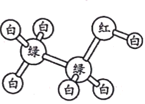
A.M与HCOOCH3互为同分异构体
B.N的官能团为羟基
C.在与钠的反应中N放出气泡比M快
D.N能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷、烯、炔都是常见的碳氢化合物。
(1)写出下列有机物的系统命名法名称:
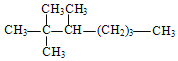 名称是_____
名称是_____
(2)有下列有机物:①CH3CH3 ②CH2=CH2 ③CH3﹣CH2﹣C≡CH ④CH3﹣C≡ C﹣CH3 ⑤C6H12 ⑥CH3﹣CH=CH2,其中互为同系物的是_____,互为同分异构体的是_____ (填编号)
(3)实验室常用浓硫酸和乙醇混合加热制取乙烯。
①实验室制乙烯的化学方程式为_____。
②关于该实验的说法中正确的是_____
a.浓硫酸只有催化剂的作用
b.可用向下排空气法收集乙烯
c.在反应容器中放入几片碎瓷片防止混合液暴沸
d.温度计应插入反应溶液液面下,以便控制温度
(3)实验后期制得的乙烯气体中常含有杂质气体 SO2和CO2,将此混合气体直接通入溴水中,若 观察到溴水褪色,能否证明乙烯发生了加成反应?_____(填“能”或“否”),原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M 是由两种阳离子、一种阴离子和结晶水组成的化合物。某学习小组的同学对该化合物进行了研究。
Ⅰ、取 M 的样品配成溶液,溶液呈棕黄色。将溶液分成三份,做了下列 3 组实验,分别检出 A、B、C 三种离子。请完成下表中的空格:
组别 | 操作 | 实验现象 | 检出的离子 |
第1组 | 加入足量的NaOH溶液并加热 | 产生的气体使湿润的红色石蕊试纸变蓝 | A:_____ |
第 2 组 | 加入KSCN溶液 | 溶液呈_____色 | B:Fe3+ |
第3组 | 加入_____和 BaCl2 溶液 | 有白色沉淀生成 | C: |
Ⅱ.取 9.640g M 配成溶液,加入足量的NaOH溶液,得到红褐色沉淀,将沉淀过滤、洗涤、灼烧,冷却后称量。经过4次灼烧,称量得到的红棕色固体的质量数据如表所示。
实验次数 | 第1次 | 第2次 | 第3次 | 第4次 |
质量 (g ) | 1.630 | 1.610 | 1.600 | 1.600 |
(1)灼烧和称量时需用图所示的仪器,它们的名称分别是:
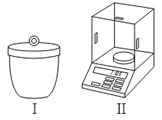
①_____②_____
(2)查阅资料并分析可知红棕色固体为Fe2O3,根据上表数据,可算得Fe2
(3)另取 9.640g M 配成溶液,加入足量的BaCl2溶液,得到白色沉淀,将沉淀过滤、洗涤、干燥,称得其质量为9.320g。小组同学提出 A、B、C 三种离子的物质的量存在以下关系:n (A )+3n (B )=2n (C),他们依据的原理是_____。
(4)分析整个实验过程,可以确定M的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
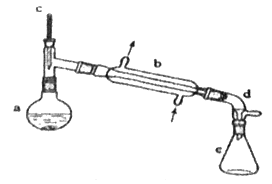
【题目】分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:
![]()
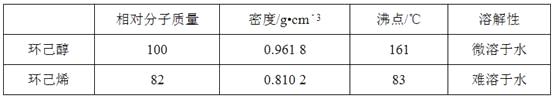
可能用到的有关数据如下:
Ⅰ.合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
Ⅱ.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__。
(2)加入碎瓷片的作用是__;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是__(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并__;在本实验分离过程中,产物应该从分液漏斗的__(填“上口倒出”或“下口倒出”)。
(4)分离提纯过程中加入无水氯化钙的目的是__。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.分液漏斗 D.牛角管 E.锥形瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
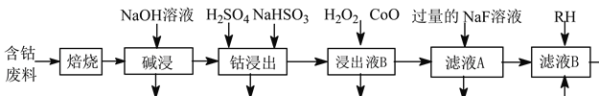
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Ni、Fe、Al2O3、CaO、炭及有机物等)制取CoC2O4的工艺流程如下:
己知:①草酸钴晶体难溶于水
②RH为有机物,可用RH、有机溶剂萃取出溶液中的Ni2+
③几种金属阳离子的氢氧化物沉淀时的PH如表所示:
Fe3+ | Co2+ | |
开始沉淀时 | 1.9 | 7.1 |
沉淀完全时 | 3.7 | 9.1 |
(1)“焙烧”的目的_______。
(2)“碱浸”过程中Al2O3发生反应的化学方程式为_______。
(3) 经硫酸酸化后,“钴浸出”过程中Co3+转化为Co2+的离子方程式为_______。
(4)“浸出液B”中加入CoO并调节pH值至3.7~7.1的目的为_______。
(5) 加入NaF溶液可将钙离子转化为沉淀并过滤除去,若所得滤液中c(F-)=1.0×10-2mol·L1,则滤液中c(Ca2+)为_______mol·L1[已知Ksp(CaF2)=1.05×10-10]。
(6) 萃取后水层中含有大量的Co2+,将水层与酸性KMnO4溶液充分混合生成Co3+、Mn2+,理论上完全反应消耗的n(Co2+)∶n(MnO4-)=_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com