
【题目】氧化锌是一种常用添加剂,广泛应用于塑料、合成橡胶、电池等产品的制造。一种利用氧化锌烟灰制备活性氧化锌的工艺流程如下:

已知:I.氧化锌烟灰的主要化学组成如下:
元素组成 | Zn | Pb | Cu | Cl | F |
质量分数% | 59.78 | 9.07 | 0.30 | 2.24 | 1.80 |
Ⅱ.浸出”时,大部分锌元素以Zn(NH3)42+形式进入溶液,同时部分Pb、Cu、F元素也进入溶液中。
(1)氨的电子式______________________。
(2)“浸出”时,氧化锌发生反应的离子方程式为_________________________________;“浸出”时温度不宜过高,其原因为____________________________________________。
(3)若“浸出”后,所得溶液中c(F-)=0.02mol/L,向其中加入等体积的氯化钙溶液(忽略溶液体积变化),使F-沉淀完全即溶液中c(F-)<10-5mol/L,则所加氯化钙溶液的浓度度最小为___________。已知:Ksp(CaF2)=3.45×10-11
(4)“置换”时,所得置换渣中除了含Zn外,还含有___________;“净化”时,利用活性炭___________性,除去溶液中残留的有机物。
(5)“沉淀”时,可得到滤渣Zn(NH3)2Cl2。所加盐酸过量时,会导致沉淀部分溶解甚至消失,其化学方程式为____________________________________________。
(6)“一次水解”时,产物为Zn(OH)xCly。取10.64g该水解产物,经二次水解、煅烧后,可得活性氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为___________。
【答案】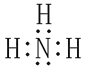 ZnO+2NH3+2NH4+=Zn(NH3)42++H2O 或 ZnO+2NH3·H2 O +2NH4+=Zn(NH3)42++3H2O 避免氨水的分解与挥发 0.70mol·L-1 Pb、Cu 吸附 Zn(NH3)2Cl2+2HCl=ZnCl2+2NH4Cl Zn(OH)1.6Cl0.4
ZnO+2NH3+2NH4+=Zn(NH3)42++H2O 或 ZnO+2NH3·H2 O +2NH4+=Zn(NH3)42++3H2O 避免氨水的分解与挥发 0.70mol·L-1 Pb、Cu 吸附 Zn(NH3)2Cl2+2HCl=ZnCl2+2NH4Cl Zn(OH)1.6Cl0.4
【解析】
(1)氨的分子式为NH3,其电子式为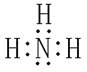 ;
;
(2)根据信息,浸出时,大部分锌元素以Zn(NH3)42+形式存在溶液中,根据流程图,反应的离子方程式为ZnO+2NH3+2NH4+=Zn(NH3)42++H2O或ZnO++2NH3·H2O+2NH4+=Zn(NH3)42++3H2O;氨水易挥发,受热易分解,因此浸出时温度不宜过高原因是防止氨水的分解与挥发;
(3)取1Lc(F-)=0.02mol·L-1浸出液,加1L氯化钙溶液,令c(Ca2+)为xmol·L-1,混合后溶液体积为2L,溶液中留下的n(F-)=2L×10-5 mol·L-1=2×10-5 mol,沉淀的n(F-)=0.02mol·L-1×1L-2×10-5 mol≈0.02mol,沉淀的n(Ca2+)=0.01mol,Ksp((CaF2)=c(Ca2+).c2(F-)=3.45×10-11,余下的溶液中c(Ca2+)=3.45×10-11/(10-5)2=0.345mol·L-1,余下的溶液中n(Ca2+)=0.345mol/L×2L=0.69mol,故加入的c(Ca2+)=(0.69mol+0.01mol)/1L=0.70mol·L-1,使F- 沉淀完全即溶液中c(F-)<10-5mol·L-1,则所加氯化钙溶液的浓度度最小为0.70mol·L-1;
(4)根据氧化锌烟灰的成分,Zn的活泼性强于Pb、Cu,"置换"时,所得置换渣中除了含Zn外,还含有Pb、Cu;净化时,利用活性炭的吸附性,除去溶液中残留的有机物;
(5)“沉淀”时,可得到滤渣Zn(NH3)Cl2,所加盐酸过量时,会导致沉淀部分溶解甚至消失,其化学方程式为Zn(NH3)2Cl2+2HCl=ZnCl2+2NH4Cl;
(6)n(ZnO)=8.1g/81g·mol-1=0.1mol,根据原子守恒,Zn(OH)xCly的物质的量为0.1mol,则M(Zn(OH)xCly)=10.64g/0.1mol=106.4g·mol-1,x+y=2,65+17x+35.5y=106.4,解得:x=1.6,y=0.4,则一次水解产物的化学式为Zn(OH)1.6Cl0.4。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】如下图所示A是固体金属单质,燃烧时火焰呈黄色。

(1)写出下列转化的化学方程式。
A→B________________;
B→C___________。
(2)列举下列物质的一种主要用途:
A_____________;
B_________________。
(3)在上述物质转化关系图中的化学反应里,没有元素化合价变化的是______(用“A→B”这样的形式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用如图所示装置,对浓硝酸与木炭的反应进行探究(已知:4HNO34NO2↑+O2↑+2H2O)。

请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,伸入三口烧瓶中,并塞紧瓶塞,滴加浓硝酸,可观察到三口烧瓶中气体的颜色为________,产生该气体的化学方程式是____________。
(2)装置C中盛有足量Ba(OH)2溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,该白色沉淀为____________(填化学式)。
(3)装置B的作用是__________________________。
(4)装置D中收集到了无色气体,部分同学认为是NO,还有部分同学认为是O2。
①下列对该气体的检验方法合适的是________。
A.敞口观察装置D中集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶中收集的无色气体是氧气,则氧气的来源是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集强氧化性、吸附、絮凝于一体的新型多功能处理剂,其生产工艺如图所示:
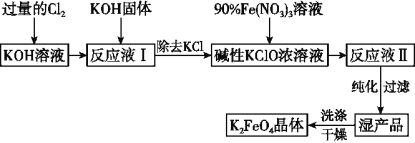
已知K2FeO4具有下列性质:
①可溶于水、微溶于浓KOH溶液
②在0~5 ℃、强碱性溶液中比较稳定
③在Fe3+和Fe(OH)3催化作用下发生分解
④在酸性至碱性条件下,能与水反应生成Fe(OH)3和O2
请完成下列填空:
(1)已知Cl2与KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,生产KClO应在温度___________的情况下进行(填“较高”或“较低”)。
(2)生产K2FeO4的反应原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O(未配平),则该反应中氧化剂与还原剂的物质的量之比为______________。
(3)K2FeO4在弱碱性条件下能与水反应生成Fe(OH)3和O2,则该反应的化学方程式为________________。
(4)在“反应液Ⅰ”中加KOH固体的目的是___________。
A. 为下一步反应提供反应物
B. 与“反应液Ⅰ”中过量的Cl2继续反应,生成更多的KClO
C. KOH固体溶解时会放出较多的热量,有利于提高反应速率
D. 使副产物KClO3转化为KCl
(5)制备K2FeO4时,须将90%的Fe(NO3)3溶液缓慢滴加到碱性的KClO浓溶液中,并且不断搅拌。采用这种混合方式的原因是_______________________ (答出1条即可)。
(6)从“反应液Ⅱ”中分离出K2FeO4晶体后,可以得到的副产品有________ (写化学式)。
(7)工业上常用“间接碘量法”测定高铁酸钾样品中高铁酸钾的含量,其方法是:用碱性的碘化钾溶液(pH为11~12)溶解3.96 g高铁酸钾样品,调节pH为1,避光放置40分钟至反应完全(高铁酸根离子全部被还原成铁离子),再调节pH为3~4(弱酸性)。以1.0 mol/L的硫代硫酸钠标准溶液为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),当达到滴定终点时,用去硫代硫酸钠标准溶液15.00 mL,则原高铁酸钾样品中高铁酸钾的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是人们最近提出的一个新概念,主要内容之一是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用。下列化学反应符合绿色化学概念的是
A. 制CuSO4:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
B. 制CuSO4:2Cu+O2![]() 2CuO;CuO+H2SO4(稀)=CuSO4+H2O
2CuO;CuO+H2SO4(稀)=CuSO4+H2O
C. 制Cu(NO3)2:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
D. 制Cu(NO3)2:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮的化合物广泛存在于自然界,是一类非常重要的化合物.回答下列有关问题:
(1)在一定条件下;2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。已知该反应相关的化学键键能数据如表一:
表一:
化学键 | | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=___________kJ/mol
(2)在恒容密闭容器中充入2 molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示.常温下,该反应能逆向自发进行,原因是____________________________________________。
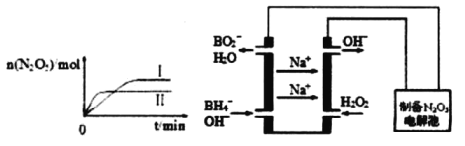
②下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为______________________。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表二是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各lmol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为______________________。
0.01mol/L的溶液 | X | Y | Z | W |
pH | 12 | 2 | 8.5 | 4.5 |
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I: 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II: 2NO(g)+Cl2(g)![]() 2ClNO(g) K2
2ClNO(g) K2
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___________(用K1、K2表示)
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___________(用K1、K2表示)
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应Ⅱ达到平衡测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=___________;其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2=___________α1 (填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】增塑剂DCHP可由环己醇制得。DCHP和环己醇的结构简式如图所示,下列说法错误的是( )
![]()
环己醇
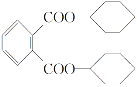
DCHP
A. DCHP的分子式为C20H26O4
B. 环己醇分子中所有碳原子不可能共平面
C. DCHP的一氯取代物有5种
D. DCHP通过取代反应可以得到环己醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应能量的说法正确的是
A. 若反应A=B △H<0,说明A物质比B物质稳定,分子内共价键键能 A比B大
B. 500 ℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g), 放热 akJ,热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H= -2a kJmol-1
2NH3(g) △H= -2a kJmol-1
C. 101kPa时,2H2(g)+O2(g)==2H2O(g);△H=-QkJ·mol-1,则H2的燃烧热为1/2QkJ·mol-l
D. 化学反应中,吸热反应不一定需要加热也能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了ng,且n>m,符合此要求的物质是( )
①H2 ②HCHO ③CH4 ④HCOOCH3⑤CH3CHO
A. ①② B. ③⑤ C. ①②③④⑤ D. ④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com