
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B、升高温度能降低反应活化能,所以反应速率加快 |
| C、中和热测定实验中需要用到的玻璃仪器有烧杯、温度计和环形玻璃棒搅拌棒三种 |
| D、等量的CH4在氧气中燃烧放出的热量与形成燃料电池放出的热量一样多 |


科目:高中化学 来源: 题型:
| A、500mL,40g |
| B、500mL,36g |
| C、450mL,36g |
| D、450mL,40g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(HCOO-)<c(Na+) |
| B、c(HCOO-)>c(Na+) |
| C、c(OH-)>c(H+) |
| D、c(OH-)>c(HCOO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
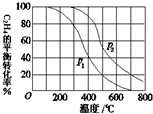 (1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产.
(1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x+y<n |
| B、该化学平衡向右移动 |
| C、B的转化率增大 |
| D、C的体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O2+H2SO4=SO2↑+O2↑+2 H2O |
| B、2I-+2Fe3+=I2+2 Fe2+ |
| C、2Fe3++SO2+2 H2O=2Fe2++SO42-+4H+ |
| D、SO2+2 H2O+I2=H2SO4+2HI |
查看答案和解析>>
科目:高中化学 来源: 题型:
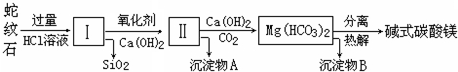
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com