
| A. | 该反应中熵变小于0、焓变大于0 | |
| B. | 判断反应能否自发进行需要根据△H与△S综合考虑 | |
| C. | 该反应是吸热反应,因此一定不能自发进行 | |
| D. | 碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
分析 A、依据反应的特征分析(NH4)2CO3((s)=NH4HCO3(s)+NH3(g)△H=+74.9kJ•mol-1,反应是熵变增大的反应,反应是吸热反应焓变大于0;
B、反应自发进行的判断依据是△H-T△S<0,反应自发进行,据此分析;
C、反应自发进行的判断依据是△H-T△S<0,反应自发进行,据此分析;
D、反应自发进行的判断依据是△H-T△S<0,反应自发进行.
解答 解:A、依据反应的特征分析(NH4)2CO3((s)=NH4HCO3(s)+NH3(g)△H=+74.9kJ•mol-1,反应是熵变增大的反应,△S>0;反应是吸热反应焓变大于0,△H>0;故A错误;
B、判断反应能否自发进行需要根据△H与△S综合考虑,判断依据是△H-T△S<0,故B正确;
C、碳酸盐分解反应中熵增加,△S>0,反应是吸热反应,△H>0,反应自发进行的判断依据是△H-T△S<0,反应自发进行,因此低温下碳酸盐分解是非自发进行的,故C错误;
D、该反应是吸热反应,△H>0,△S>0;反应自发进行的判断依据是△H-T△S<0,当高温下反应可以自发进行,故B错误;
故选B.
点评 本题考查了反应自发进行的判断依据,理解自发进行的因素是由焓变和熵变温度共同决定,题目较简单.


科目:高中化学 来源: 题型:选择题
| 阳离子 | K+、Ba2+、Fe2+、Al3+、Fe3+、Mg2+ |
| 阴离子 | OH-、HCO3-、CO32-、Cl-、NO3-、SO42- |
| A. | 由①、②判断,溶液中一定不含有的阳离子是K+、Fe3+ | |
| B. | 实验③中的气体不可能为CO2 | |
| C. | 综合分析判断,原溶液中所含的离子为:Fe2+、Mg2+、Cl-、NO3-、SO42- | |
| D. | 若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、灼烧至恒重,得到的固体质量为8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
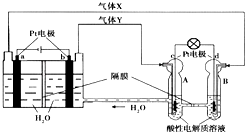 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )| A. | 当有0.1mol电子转移时,a极产生1.12L O2(标况) | |
| B. | b极上发生的电极反应是:2H++2e-═H2↑ | |
| C. | d极上发生的电极反应是:O2+4H++4e-═2H2O | |
| D. | c极上进行还原反应,B中的H+可以通过隔膜进入A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
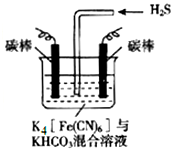 [Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )| A. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 | |
| B. | 电解时阴极反应式为:2HCO3-+2 e-═H2↑+2CO32- | |
| C. | 当电解过程中有22.4L标准状况下的H2生成时,溶液中有32gS析出(溶解忽略不计) | |
| D. | 电解时阳极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯碱工业是电解熔融的NaCl,阳极产生Cl2 | |
| B. | 氢氧燃料电池可将热能直接转化为电能 | |
| C. | 原电池工作时,电子从负极经外电路移向正极 | |
| D. | 工业上电解熔融的AlCl3来制取铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
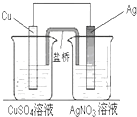 用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )
用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
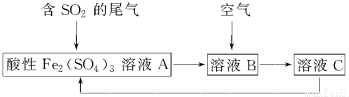
| A. | 溶液B中发生的反应为2SO2+O2═2SO3 | |
| B. | 可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+ | |
| C. | 由以上流程可推知氧化性:Fe3+>O2>SO42- | |
| D. | 此工艺的优点之一是物质能循环利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com