
T℃,向5L恒容密闭容器中充入1molSO3气体,发生反应2SO3(g)⇌2SO2(g)+O2(g)
△H=+196kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量.当温度度不变时,改变某一条件,下列结论正确的是( )
| 条件改变 | 结论 | |
| A | 平衡后向容器中充入1molHe | 平衡常数不变,混合气体的密度也不变 |
| B | 起始时向容器中充入0.5molSO2、0.25molO2和2molSO3 | 反应达到平衡前v(正)>v(逆) |
| C | 起始时向容器中充入1molSO2和0.5mol O2 | 达到平衡时共放出78.4kJ的热量 |
| D | 起始时向容器中充入1molSO2和0.5molO2 | 达到平衡时,SO2的转化率为60% |
|
| A. | A | B. | B | C. | C | D. | D |
| 化学平衡建立的过程;化学平衡的影响因素. | |
| 专题: | 化学平衡专题. |
| 分析: | A、恒容容器中加入惰气总压增大分压不变,平衡不动,平衡常数随温度变化,混合气体密度= B、充入2.0molSO3、0.50mol SO2和0.25mol O2 转化为起始量相当于充入2.5molSO3,相当于相同的平衡叠加,压强增大,平衡逆向进行; C、充入1.0molSO2和0.50molO2 和充入1.0molSO3气体达到的平衡状态相同,依据平衡三段式计算; D、依据平衡状态下计算得到平衡常数,结合化学平衡三段式列式计算. |
| 解答: | 解:A、平衡后向容器中充入1.0molHe,恒容容器中加入惰气总压增大分压不变,平衡不动,温度不变平衡常数不变化,加入氦气,气体质量增多,体积不变,密度增大,故A错误; B、充入2.0molSO3、0.50mol SO2和0.25mol O2 转化为起始量相当于充入2.5molSO3,相当于相同的平衡叠加,压强增大,平衡逆向进行,反应达到平衡前v(正)<v(逆),故B错误; C、依据平衡三段式计算 2SO3(g)⇌2SO2(g)+O2(g)△H=+196kJ/mol 起始量 1 0 0 变化量 0.2 0.2 0.1 19.6 平衡量 0.8 0.2 0.1 起始时向容器中充入1.0molSO2和0.50molO2,反应达到相同平衡,反应的二氧化硫物质的量为0.8mol,放热196KJ×0.4=78.4KJ,故C正确; D、依据C计算平衡常数K= 2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196kJ/mol 平衡常数K= 起始量(mol/L) 0.2 0.1 0 变化量(mol/L) 0.12 0.06 0.12 平衡量(mol/L) 0.08 0.04 0.12 K= 故选C. |
| 点评: | 本题考查化学平衡的分析判断,化学平衡的计算应用,平衡常数随温度变化,题目难度中等. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
乙醇分子中不同的化学键如图: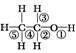 ,关于乙醇在各种反应中断裂键的说法不正确的是( )
,关于乙醇在各种反应中断裂键的说法不正确的是( )
A.乙醇和钠反应,键①断裂
B.在Ag催化下和O2反应,键①③断裂
C.乙醇和浓H2SO4共热140℃时,键①或键②断裂;在170℃时,键②⑤断裂
D.乙醇完全燃烧时断裂键①②
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)金属导电靠________,电解质溶液导电靠________。
(2)影响金属键强弱的因素有_______________、_______等。一般说来,金属键越强,则金属的熔点________,硬度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
298K、10lkPa时,1molH2(g)与O2(g)完全反应生成H2O(g)时放出242kJ热量,而生成H2O(1)时放出286kJ热量,则下列表达不正确的是( )
|
| A. | 2H2(g)+O2(g)=2H2O(g);△H=﹣484kJ•mol﹣1 |
|
| B. | H2O(g)=H2(g)+ |
|
| C. | H2(g)+ |
|
| D. | H2O(1)=H2O(g);△H=﹣44kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2在一定温度下,在定压容器a与定容容器b中,分别通入等量且体积比为1:3的N2和H2,开始时体积相同,达到平衡时,N2的转化率是( )
|
| A. | a大 | B. | b大 | C. | a、b一样大 | D. | 不一定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成氨的反应为N2(g)+3H2(g)⇌2NH3(g).设t℃在容积为2L的密闭容器中充入0.6mol N2和1.6mol H2,反应在一定条件下达到平衡时,NH3的物质的量分数为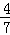 .计算:
.计算:
(1)达到平衡时H2的物质的量;
(2)t℃该反应的平衡常数.
查看答案和解析>>
科目:高中化学 来源: 题型:
在甲、乙两个密闭容器中,发生如下反应:2A(g)  B(g) +2C(s); △H=mkJ ·mol-1。有下列两种图像。下列叙述正确的是( )
B(g) +2C(s); △H=mkJ ·mol-1。有下列两种图像。下列叙述正确的是( )
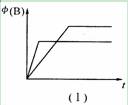

A.若甲为恒容体系,图像(I)代表温度不同时,时间与B的体积分数关系图,则m >0
B.恒温条件下,图像 (I)可能代表压强不同时,时间与B的体积分数关系图
C.恒温条件下,若甲、乙两容器体积相同,起始时分别向甲中充入2 molA,乙中充入1molB、3 molC,则达到平衡后两容器中B的体积分数一定不同
D. 恒温条件下,乙容器存在图像 (II)的关系,则当x代表压强时,y可代表B的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
在一固定体积的密闭容器中,可逆反应,nA(g)+mB (g)⇌pC(g)已经达到平衡状态.已知n+m>p,正反应为放热反应.下列分析结论中正确的是( )
①升温,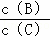 的值变小;
的值变小;
②降温,平衡体系内混合气体的平均相对分子质量变小;
③增加B的物质的量,A的转化率增大;
④使用催化剂,气体总的物质的量不变;
⑤加压使密闭容器的容积变小,A或B的浓度则变大;
⑥若A的反应速率为v(A),则v(B)=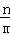 [v(A)].
[v(A)].
|
| A. | ①② | B. | ②③④ | C. | ③④⑤ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.CHCl3是正四面体形
B.H2O分子中氧原子为sp2杂化,其分子几何构型为V形
C.二氧化碳中碳原子为sp杂化,为直线形分子
D.NH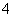 是三角锥形
是三角锥形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com