
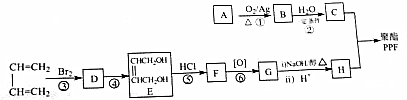

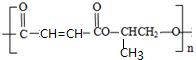 .
. 分析 烃A含碳量为85.7%,其相对分子质量为42,则A的分子式为C3H6,A氧化得B,结合信息②可知,A为CH3CH=CH2,B为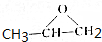 ,C为CH3CHOHCH2OH,根据E的结构简式可知CH2=CHCH=CH2与溴 发生1,4-加成生成D为BrCH2CH=CHCH2Br,D发生碱性水解生成E,E与氯化氢发生加成反应生成F为HOCH2CH2CHClCH2OH,F发生氧化反应生成G为HOOCCH2CHClCOOH,G发生消去反应再酸化得H为HOOCCH=CHCOOH,C和H发生缩聚反应可得PPF为
,C为CH3CHOHCH2OH,根据E的结构简式可知CH2=CHCH=CH2与溴 发生1,4-加成生成D为BrCH2CH=CHCH2Br,D发生碱性水解生成E,E与氯化氢发生加成反应生成F为HOCH2CH2CHClCH2OH,F发生氧化反应生成G为HOOCCH2CHClCOOH,G发生消去反应再酸化得H为HOOCCH=CHCOOH,C和H发生缩聚反应可得PPF为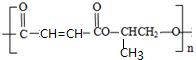 ,据此答题.
,据此答题.
解答 解:烃A含碳量为85.7%,其相对分子质量为42,则A的分子式为C3H6,A氧化得B,结合信息②可知,A为CH3CH=CH2,B为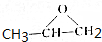 ,C为CH3CHOHCH2OH,根据E的结构简式可知CH2=CHCH=CH2与溴 发生1,4-加成生成D为BrCH2CH=CHCH2Br,D发生碱性水解生成E,E与氯化氢发生加成反应生成F为HOCH2CH2CHClCH2OH,F发生氧化反应生成G为HOOCCH2CHClCOOH,G发生消去反应再酸化得H为HOOCCH=CHCOOH,C和H发生缩聚反应可得PPF为
,C为CH3CHOHCH2OH,根据E的结构简式可知CH2=CHCH=CH2与溴 发生1,4-加成生成D为BrCH2CH=CHCH2Br,D发生碱性水解生成E,E与氯化氢发生加成反应生成F为HOCH2CH2CHClCH2OH,F发生氧化反应生成G为HOOCCH2CHClCOOH,G发生消去反应再酸化得H为HOOCCH=CHCOOH,C和H发生缩聚反应可得PPF为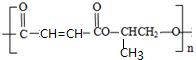 ,
,
(1)A为CH3CH=CH2,A的分子式为C3H6,C为CH3CHOHCH2OH,C的名称为1,2-丙二醇,
故答案为:C3H6;1,2-丙二醇;
(2)D为BrCH2CH=CHCH2Br,D中含有的官能团名称为溴原子和碳碳双键,反应④是卤代烃的碱性水解,所以的反应条件为氢氧化钠溶液、加热,根据上面的分析可知,反应①~⑥中属于取代反应的是④,
故答案为:溴原子和碳碳双键;氢氧化钠溶液、加热;④;
(3)根据上面的分析可知,聚酯PPF的结构简式为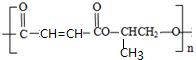 ,故答案为:
,故答案为: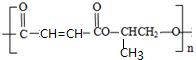 .
.
点评 本题考查有机物的推断,为高频考点,把握合成中碳链变化、官能团变化及反应条件推断物质为解答的关键,侧重分析与推断能力的综合考查,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
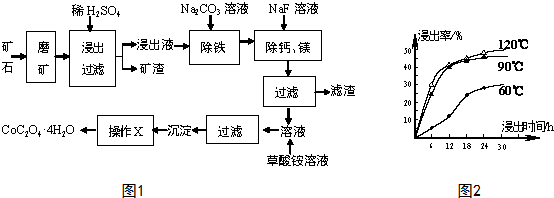
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
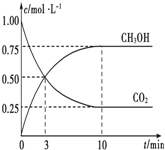 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )| A. | 欲增大平衡状态时$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$的比值,可采用升高温度的方法 | |
| B. | 达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 欲提高H2的平衡转化率只能加压减小反应容器的体积 | |
| D. | 从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | a | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X、Y位于第ⅠA族,则X、Y可能与氧元素形成原子个数比为1:1或2:1的化合物 | |
| B. | 若X、Y位于第三周期,则X、Y形成的化合物可能是离子化合物,也可能是共价化合物 | |
| C. | 若气态HnX的沸点高于HnY,则X、Y只能位于元素周期表的第ⅥA族 | |
| D. | 若X、Y位于周期表的同一周期,则最高价含氧酸的酸性可能是HnXOm>HaYOb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③ | C. | ②④ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com