
【题目】在2NO2![]() N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
A. N2O4和NO2的分子数比为1:2
B. N2O4和NO2的浓度相等
C. 体系的颜色不再改变
D. 单位时间内有1molN2O4转化为NO2的同时,有2molNO2转化为N2O4
【答案】CD
【解析】A.平衡时各物质的分子数之比取决于物质的起始物质的量和转化率,故N2O4和NO2的分子数比为1:2不能作为判断是否达到平衡状态的依据,故A错误;B.平衡时各物质的浓度大小关系取决于物质的起始物质的量和转化率,故N2O4和NO2的浓度相等不能作为判断是否达到平衡状态的依据,故B错误;C.N2O4为无色气体,二氧化氮为红棕色气体,故平衡体系的颜色一定不再改变可作为判断是否达到化学平衡状态的依据,故C正确;D.单位时间有1molN2O4变为NO2是正反应,同时有2molNO2变为N2O4为逆反应,且化学反应速率之比等于化学计量数之比,故正逆反应速率相等,说明达到平衡状态,故D正确;故选CD。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】某二价金属的碳酸盐和碳酸氢盐的混合物与足量盐酸反应。消耗H+和产生CO2的物质的量之比为5:4,该混合物中碳酸盐和碳酸氢盐的物质的最之比为( )
A. 1:2 B. 2:3 C. 3:4 D. 4:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会密切相关。下列说法不正确的是()
A. 少开汽车可一定程度地减缓雾霾现象
B. 为提高作物产量大量使用农药和化肥
C. 使用无磷洗衣粉能缓解水体富营养化
D. 合理利用可燃冰有利于弥补能源短缺
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某溶液中由水电离的c(OH-)为1.0×10-12mol·L-1,下列离子在该溶液中一定能大量共存的是( )
A.NH4+、Na+、SO42-、Cl- B.Ba2+、K+、Fe3+、I-
C.Ba2+、K+、Cl-、NO3- D.Na+、Ca2+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁及其化合物的说法中不正确的是( )
A. 工业上在高温下用CO还原含Fe2O3的铁矿石炼铁
B. 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4
C. 工业上可用铁质容器储存、运输浓硝酸和浓硫酸
D. 氯化铁溶液有较强氧化性,故可用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑧八种元素在周期表中的位置:
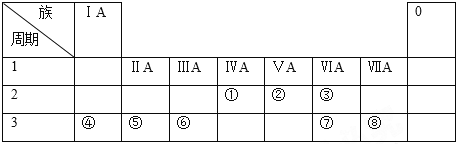
请回答下列问题:
(1)①、②、③三种元素中非金属性最强的是_________(用元素符号表示)。
(2)④、⑥两种元素的最高价氧化物的水化物在溶液中相互反应的化学方程式____________________________________。
(3)画出⑤的原子结构示意图____________。
(4)⑦、⑧两种元素原子半径大小比较__________(用元素符号表示)。
(5)画出⑧的氢化物的电子式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统的制备合成氨原料气H2的方法是水煤气法。已知:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=﹢131.3kJ·mol-1
②C(s)+2H2O(g)=CO2(g)+2H2(g) △H2=﹢90.2kJ·mol-1
③CO(g)+H2O(g)=CO2(g)+H2(g) △H3
(1)反应①△H1>0,在一定条件下,能自发进行的原因是_______________;△H3=__________kJ·mol-1。
(2)已知800℃时:CO(g)+H2O(g)![]() CO2(g)+H2(g) K=1.0。在此温度下向一2L的恒温恒容密闭容器中充入2molH2O(g)和2molCO,2min后达到平衡,则平衡时CO2的物质的量浓度为_______________;从反应开始至达到平衡时H2O的平均反应速率为_______________。
CO2(g)+H2(g) K=1.0。在此温度下向一2L的恒温恒容密闭容器中充入2molH2O(g)和2molCO,2min后达到平衡,则平衡时CO2的物质的量浓度为_______________;从反应开始至达到平衡时H2O的平均反应速率为_______________。
(3)900℃时,反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g)的平衡常数K__________1.0(填“>”“<”或“=”)。
CO2(g)+H2(g)的平衡常数K__________1.0(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com