
 (g)
(g)| FeSO4/Al2O3 |
| 高温 |
 (g)+3H2(g)
(g)+3H2(g)
| c(C6H6)?c3(H2) |
| c((C6H12) |
| c(C6H6)?c3(H2) |
| c((C6H12) |
| b×(3b)3 |
| (a-b) |
| 27b4 |
| a-b |
| 27b4 |
| a-b |
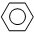
| 10mol×24%-X |
| 10mol-3Xmol+5.6mol |
| 7.2mol |
| 11.2mol |


科目:高中化学 来源: 题型:
| A、氯气用于制备漂白粉 |
| B、单质硅用于制造光导纤维 |
| C、氧化铝的熔点很高,可用于制作耐高温材料 |
| D、三氧化二铁用于生产红色颜料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、足量二氧化硫气体通人品红溶液中,溶液由红色变为无色 |
| B、二氧化氮气体通入水中,气体由红棕色变为无色 |
| C、热的氧化铜加入乙醇中,无色乙醇变绿色 |
| D、新制氢氧化铜悬浊液中加入葡萄糖溶液,加热,沉淀由蓝色变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、②④⑥ |
| C、①③⑥ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA |
| B、在标准状况下,22.4L水的质量约为18g |
| C、22g二氧化碳与标准状况下11.2LHCl含有相同的分子数 |
| D、22.4L氮气含氮分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、m=53 c2=
| ||
| B、m=-26.5 c2=a-b | ||
| C、m=-170.5 2c=a-b | ||
D、m=26.5 c2=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一份 | 第二份 | 第三份 | |
| 样品质量 | 4.35 | 8.70 | 17.40 |
| SO2体积(L) | 0.448 | 0.896 | 1.12 |
| 硫的质量 | 0.480 | 0.960 | 1.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学能可以转变成热能和电能 |
| B、凡是放热反应的发生均无需加热 |
| C、凡是需要加热后才能发生的反应是吸热反应 |
| D、伴有能量变化的物质变化都是化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com