
| A. | 2 mol SO2和足量O2反应,必定生成2 mol SO3 | |
| B. | 平衡时,SO2消耗速率必定等于O2生成速率的两倍 | |
| C. | 其他条件不变,增大压强,平衡必定向正反应方向移动 | |
| D. | 平衡时,SO2浓度必定等于O2浓度的两倍 |
分析 A.反应为可逆反应,反应物不能完全转化;
B.当正逆反应速率相等时,化学反应达到平衡状态;
C.如果通入惰性气体,压强增大,但平衡不移动;
D.平衡时的浓度大小取决于起始配料比以及转化的程度,不能确定.
解答 解:A.反应为可逆反应,反应物不能完全转化,2体积SO2和足量O2反应,生成SO3的体积小于2体积,故A错误;
B.正逆反应速率相等时,化学反应达到平衡状态,则SO2消耗速率等于O2生成速率的两倍时达到平衡状态,故B正确;
C.其他条件不变,缩小体积,压强增大,平衡必定向右移动,故C错误;
D.平衡时的浓度大小取决于起始配料比以及转化的程度,平衡时,SO2浓度与O2浓度的浓度关系不确定,不能作为判断是否达到平衡的依据,故D错误.
故选B.
点评 本题考查化学平衡状态的判断以及影响平衡的因素,题目难度不大,本题注意把握化学平衡的特征,易错点为C,注意引起压强增大的因素与反应物浓度的关系.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的电子式: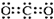 | B. | 14C的原子结构示意图: | ||
| C. | C3H8的结构式CH3-CH2-CH3 | D. | 次氯酸的电子式: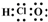 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
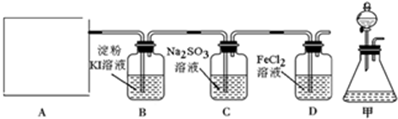

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 C的离子结构示意图:
C的离子结构示意图: .
.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.| A. | a<b | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | 上述反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
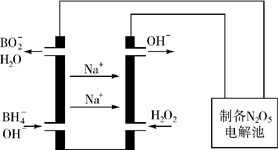 氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.
氮的重要化合物如氨、肼(N2H4)、NO、NO2、HNO3、硝酸盐等,在生产、生活中具有重要作用.| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法、热还原法、热分解法 | B. | 热还原法、热分解法、电解法 | ||
| C. | 热分解法、热还原法、电解法 | D. | 电解法、热分解法、热还原法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com