
【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有少量不与酸作用的可溶性杂质,试根据实验回答:
(1)准确称取4.0g烧碱样品。
(2)将样品配成250mL待测液。
(3)用____________(填仪器名称)量取25.00mL待测液于锥形瓶中,并滴加几滴甲基橙作指示剂。
(4)用0.2010 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时,两眼注视____________,直到滴定终点。达到终点的具体现象是:____________。
(5)若两次实验滴定的数据如下表:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 5.00 | 28.30 |
第三次 | 25.00 | 4.00 | 24.10 |
根据上述各数据,计算烧碱的纯度:____________
(6)下列操作中,会导致所测得的烧碱的纯度偏大的是________。
a.滴定终点时,俯视刻度
b.没有用盐酸标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
【答案】碱式滴定管 锥形瓶中溶液颜色变化 滴入最后一滴标准液,溶液由黄色变为橙色,且半分钟不变回原色。 40.2% b
【解析】
(3)用碱式滴定管量取烧碱溶液于锥形瓶中
(4)根据滴定规范性的操作要求答题;
(5)根据数据的有效性计算消耗的盐酸标准液的平均体积,再结合公式c(测) =  计算,进而计算纯度;
计算,进而计算纯度;
(6)根据错误操作对消耗的标准盐酸溶液体积的影响来分析作答。
(3)烧碱属于碱,在中和滴定中需用碱式滴定管量取,用锥形瓶盛放待测液,故答案为:碱式滴定管;
(4)滴定时左手旋转酸式滴定管,右手不停地摇动锥形瓶,两眼需注视锥形瓶中溶液颜色变化;滴定终点现象是:滴入最后一滴标准液,溶液由黄色变为橙色,且半分钟不变回原色,故答案为:锥形瓶中溶液颜色变化;滴入最后一滴标准液,溶液由黄色变为橙色,且半分钟不变回原色;
(5)由表格信息可知,标准液的体积分别为:(20.40-0.50) mL =19.90mL,(28.30-5.00)mL=23.30mL,(24.10-4.00)=20.10mL,则可知第二组数据误差较大,无效,消耗的盐酸溶液平均体积为![]() =20.00mL,代入公式c(测) =
=20.00mL,代入公式c(测) =  可得:=
可得:=![]() =0.1608molL1,则250mL待测液中氢氧化钠的物质的量为0.1608molL1
=0.1608molL1,则250mL待测液中氢氧化钠的物质的量为0.1608molL1![]() 0.25L=0.0402 mol,烧碱的纯度=
0.25L=0.0402 mol,烧碱的纯度=![]() =40.2%,故答案为:40.2%;
=40.2%,故答案为:40.2%;
(6) a.滴定终点时,俯视刻度,则读数偏小,所有标准溶液的体积偏小,求出的待测液的浓度偏小,最终导致纯度偏小,不符合题意,a不选;
b.没有用盐酸标准溶液润洗相应的滴定管,则标准液被稀释,消耗的标准液的体积偏大,使待测液的浓度计算偏大,最终导致纯度偏大,符合题意,b项选;
c.锥形瓶中有少量的蒸馏水,对所测待测液的浓度无影响,不符合题意,c项不选;
故答案为:b。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】多种短周期非金属元素的气态氧化物常会造成一些环境污染问题,化学工作者设计出将工业废气中污染物再利用的方案,以消除这些不利影响。
(1)以NH3、CO2为原料生产重要的高效氮肥——尿素[CO(NH2)2],两步反应的能量变化示意图如下:
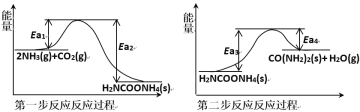
写出以氨气和二氧化碳气体为原料合成尿素的热化学方程式_________,已知两步反应中第二步反应是生产尿素的决速步骤,可判断Ea1_____Ea3(填“>”、“<”或“=”)。
(2)向体积为2 L的恒温恒容容器中通入2 mol CO和2 mol SO2,发生反应2CO(g)+SO2(g)![]() 2CO2(g)+S(s)。若反应进行到10 min时达平衡,测得CO2的体积分数为0.5,则前16 min的平均反应速率v(CO)=____,该温度下反应化学平衡常数K=____。
2CO2(g)+S(s)。若反应进行到10 min时达平衡,测得CO2的体积分数为0.5,则前16 min的平均反应速率v(CO)=____,该温度下反应化学平衡常数K=____。
(3)利用“亚硫酸盐法”吸收工业废气中的SO2。

①室温条件下,将工业废气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示,b点溶液中n(![]() )∶n(
)∶n(![]() )=________。
)=________。
②已知室温条件下,Ka1(H2SO3) =1.5×10-2;Ka2(H2SO3) =1.0×10-7;Kb(NH3H2O) =1.8×10-5。室温下,0.1molL-1的(NH4)2SO3溶液中离子浓度(不考虑OH-)由大到小顺序为________。
(4)利用电解烧碱和食盐的混合液,使工业废气脱氮,原理如图。
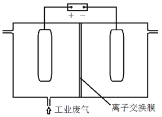
①NO被阳极产生的氧化性物质氧化为![]() 反应的离子方程式:_________________。
反应的离子方程式:_________________。
②为使该电解装置能较长时间正常工作,保持两极电解质溶液导电能力相对稳定,该装置中应使用_______ 离子交换膜(填“阴”或“阳”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列曲线中,纵坐标表示生成氢氧化铝的量,横坐标表示加入试剂的体积。从下边图中选出选项:
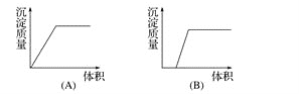

(1)向盐酸酸化的氯化铝溶液中逐滴滴入氨水至过量__________。
(2)向氢氧化钠与偏铝酸钠混合液中通入二氧化碳过量__________。
(3)向氨水中逐滴滴入氯化铝溶液至过量__________。
(4)向氯化铝溶液中滴加氢氧化钠至过量__________。
(5)向偏铝酸钠溶液滴加盐酸至过量______________。
(6)向氯化镁和氯化铝混合液中加氢氧化钠至过量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是

A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是______。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)______。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为______。
②完成NaClO3氧化FeCl2的离子方程式:
___![]() +___Fe2++___=___Cl+___Fe3++__
+___Fe2++___=___Cl+___Fe3++__
(3)FeCl3在溶液中分三步水解:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]()
![]() +H+ K2
+H+ K2
![]() +H2O
+H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是__________。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)______。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)______。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是___。
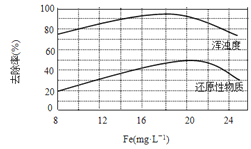
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为_____mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是城市主要污染之一,治理的一种办法是在汽车排气管上装催化转化器,它使一氧化氮与一氧化碳反应生成可参与大气生态循环的无毒气体,并促使烃类充分燃烧及二氧化硫的转化,下列说法错误的是
A. 一氧化氮与一氧化碳反应的化学方程式为2CO+2NO![]() 2CO2+N2
2CO2+N2
B. 此方法的缺点是由于二氧化碳的增多,会大大提高空气的酸度
C. 为减少城市污染应开发新能源
D. 汽车尾气中有两种气体与血红蛋白结合而使人中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃分子的球棍模型(如图),据此回答下列问题:
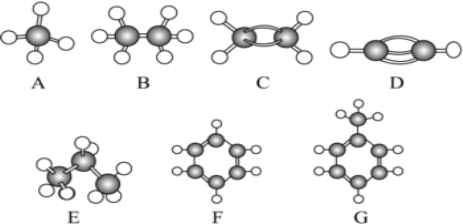
(1)常温下含氢量最高的烃是(填对应字母)________________;
(2)能够发生加成反应的烃有(填数字)________种;
(3)写出A失去一个氢原子形成的甲基的电子式______________________;
(4)F与浓硝酸和浓硫酸的混酸水浴加热生成的有机产物的名称为____________
(5)上述物质中互为同系物的是______________________或_______________(填对应字母)
(6)D与等物质的量溴反应的化学方程式为_________________所得产物的名称为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________,烧杯间填满碎塑料泡沫的作用是______.
(2)大烧杯上如不盖硬纸板,则求得的中和热数值______________(填“偏大”、“偏小’、“无影响”)
(3)实验中改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热的数值______(填“相等”或“不相等”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com