
 (1)铝热反应在工业生产中的重要用途之一是焊接钢轨或冶炼难熔金属等;用化学方程式表示出其中的原理2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe(举一例).铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸、碱破坏,若将表面有一层氧化铝薄膜的铝条和氢氧化钠溶液作用,反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(1)铝热反应在工业生产中的重要用途之一是焊接钢轨或冶炼难熔金属等;用化学方程式表示出其中的原理2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe(举一例).铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸、碱破坏,若将表面有一层氧化铝薄膜的铝条和氢氧化钠溶液作用,反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O、2Al+2NaOH+2H2O=2NaAlO2+3H2↑.分析 (1)铝热反应中放出大量的热,可冶炼难熔金属等,如Al与氧化铁反应生成氧化铝和Fe;氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
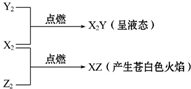
(2)根据转化关系,X2、Z2点燃火焰呈苍白色,应为氢气在氯气中燃烧,X2、Y2、点燃生成液态物质,且X、Y原子个数比为2:1,可知X2Y为水,所以X2 为H2,Y2为O2,Z2为Cl2,据此答题.
解答 解:(1)铝热反应中放出大量的热,可用来焊接钢轨或冶炼难熔金属等,如Al与氧化铁反应生成氧化铝和Fe,该反应为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,该离子反应为Al2O3+2NaOH═2NaAlO2+H2O,铝与氢氧化钠反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:焊接钢轨或冶炼难熔金属等;2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;Al2O3+2NaOH═2NaAlO2+H2O;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)根据转化关系,X2、Z2点燃火焰呈苍白色,应为氢气在氯气中燃烧,X2、Y2、点燃生成液态物质,且X、Y原子个数比为2:1,可知X2Y为水,所以X2 为H2,Y2为O2,Z2为Cl2,
(1)根据上面的分析可知,X2、Y2、Z2分别是H2、O2、Cl2,
故答案为:H2、O2、Cl2;
(2)氯气与水反应生成氯化氢和次氯酸钠,反应的化学方程式为Cl2+H2?HCl+HClO,是氧化还原反应,
故答案为:是;
(3)氯气与NaOH溶液反应生成氯化钠和次氯酸钠,反应的离子方程式为Cl2+2OH=Cl-+ClO-+H2O,
故答案为:Cl2+2OH=Cl-+ClO-+H2O.
点评 本题主要考查是H2、O2、Cl2 的性质,内容比较简单,注重基础知识的考查,答题时注意根据反应现象和物质的组成、状态等进行推断,注意化学用语的正确表达.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有2nmol(NH4)2SO4分解 | B. | 有$\frac{n}{2}$molS原子被氧化 | ||
| C. | 生成$\frac{n}{6}$mol氧化产物 | D. | 生成7nmolH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶常用作袋装食品的干燥剂,也可用作催化剂的载体 | |
| B. | 过渡元素金属作半导体材料 | |
| C. | 考古时利用14C测定一些文物的年代 | |
| D. | 纯净的SiO2是现代光学及光纤制品的基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28gCO与N2的混合物中含有的分子总数为NA | |
| B. | 常温、常压下,22.4LO2中含有的O2分子数为NA | |
| C. | 1L1mol•L-1K2SO4溶液中含有的钾离子数为2NA | |
| D. | 过量的铁1molCl2充分反应时,铁失去的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LO2中一定含有NA个氧原子 | |
| B. | 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L | |
| C. | 标准状况下,NA个H2O分子的体积是22.4L | |
| D. | 3.4gNH3含有的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
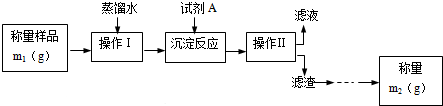
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
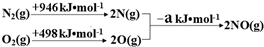
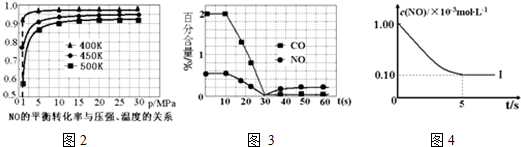
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按要求完成下列问题:
按要求完成下列问题: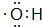 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com