
| A����ϡ��Һ��������ͼӦ���к�����ֵ����� |
| B����ϡ��Һ��1mol���1mol�Ӧ�ų������������ |
| C����ϡ��Һ��HCl��NaOH��Ӧ���к�����HNO3��KOH��Ӧ���к�����ֵ��� |
| D����Ũ�����������������Һ�иպ�����1molˮʱ��������������Ϊ�к��� |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Q1>Q2 | B��Q1��Q 2 | C��Q1<Q2 | D����ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
 ����Ӧ���������ų��������ɼ����к��ȡ��Իش��������⡣
����Ӧ���������ų��������ɼ����к��ȡ��Իش��������⡣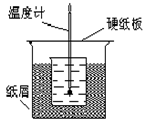
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������������һ�����ڷ�Ӧ�������� |
| B���ֽⷴӦһ�������ȷ�Ӧ |
| C��Ӧ�ø�˹���ɣ��ɼ���ijЩ����ֱ�Ӳ����ķ�Ӧ���ʱ� |
| D��ͬ��ͬѹ�£�H2(g)+Cl2(g) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��H= ��99kJ��mol-1����ش��������⣺
��H= ��99kJ��mol-1����ش��������⣺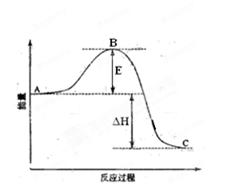
 ��1��ͼ��A��C�ֱ��ʾ ��E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ��
��1��ͼ��A��C�ֱ��ʾ ��E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ�� ��2��ͼ�С�H= KJ��mol-1��
��2��ͼ�С�H= KJ��mol-1���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 C(g)+D(g)�����е������仯����ͼ��ʾ���жϸ÷�Ӧ��H 0 ���������������������ȷ��������
C(g)+D(g)�����е������仯����ͼ��ʾ���жϸ÷�Ӧ��H 0 ���������������������ȷ��������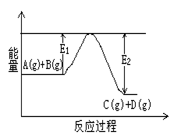
 O���Ȼ�ѧ����ʽΪ ��
O���Ȼ�ѧ����ʽΪ �� ����Һ̬˫��ˮ��H2O2����
����Һ̬˫��ˮ��H2O2�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��CH3OH��l��+3/2O2��g����CO2��g��+2H2O��l����H="+725.8" kJ/mol |
| B��2CH3OH��l��+3O2��g����2CO2��g��+4H2O��l����H=��1452 kJ/mol |
| C��2CH3OH��l��+3O2��g����2CO2��g��+4H2O��l����H=��725.8 kJ/mol |
| D��2CH3OH��l��+3O2��g����2CO2��g��+4H2O��l����H="+1452" kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��C��s����O2��g��="==CO(g)" ��H ="��110.5" kJ/mol |
| B��C��s����O2��g��===CO2(g) ��H =��393.5 kJ/mol |
| C��2H2(g)��O2(g)===2H2O(l) ��H =��571.6 kJ/mol |
| D��H2(g)��1/2O2(g)===H2O(g) ��H =��241.8 kJ/mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com