
【题目】如图是一个化学过程的示意图.请回答下列问题: 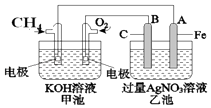
(1)甲池是装置(填“原电池”或“电解池”),B(石墨)电极的名称 是 .
(2)写出电极反应式: 通入CH4的电极;A(Fe)电极 .
(3)甲池中反应的离子方程式为 .
(4)乙池中反应的化学方程式为 .
(5)若乙池溶液体积为500mL,且忽略电解过程中溶液体积的变化,当乙池中 A极的质量增加5.40g时: ①甲池中理论上消耗O2体积为(标准状况下);
②乙池中所得溶液的pH= .
【答案】
(1)原电池;阳极
(2)CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O; Ag++e﹣═Ag
(3)CH4+2O2+2OH﹣═CO32﹣+3H2O
(4)4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3
4Ag+O2↑+4HNO3
(5)280mL;1
【解析】解:(1)根据反应方程式知,甲装置是一个燃料电池,所以甲是把化学能转变为电能的装置,是原电池;乙有外加电源,所以是电解池,
B(石墨)与原电池的正极相连,所以电极的名称是阳极,所以答案是:原电池;阳极;(2)通入CH4的电极是原电池的负极发生氧化反应,电极反应式为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;A(Fe)电极是电解池的阴极银离子发生还原反应,电极反应式为:Ag++e﹣═Ag,所以答案是:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;Ag++e﹣═Ag;(3)甲池中反应的离子方程式为CH4+2O2+2OH﹣═CO32﹣+3H2O,所以答案是:CH4+2O2+2OH﹣═CO32﹣+3H2O;(4)乙池相当于惰性电极电解硝酸银溶液,化学方程式为:4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3,所以答案是:4AgNO3+2H2O
4Ag+O2↑+4HNO3,所以答案是:4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3;(5)①铁电极上析出银,A(Fe)极的质量增加5.40g时转移电子的物质的量=
4Ag+O2↑+4HNO3;(5)①铁电极上析出银,A(Fe)极的质量增加5.40g时转移电子的物质的量= ![]() ×1=0.05mol,根据串联电路中转移电子相等,得甲池中理论上消耗O2体积=
×1=0.05mol,根据串联电路中转移电子相等,得甲池中理论上消耗O2体积= ![]() =280mL,所以答案是:280mL;
=280mL,所以答案是:280mL;
②4HNO3~转移4mol的电子,所以转移电子的物质的量为:0.05mol,所以生成硝酸的物质的量为0.05mol,c= ![]() =
= ![]() =0.1mol/L,所以PH=1,所以答案是:1.
=0.1mol/L,所以PH=1,所以答案是:1.


科目:高中化学 来源: 题型:
【题目】酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡.
(1)氨水是中学常见的碱溶液 ①下列事实可证明NH3H2O是弱碱的是(填字母序号).
A.常温下,0.1molL﹣1氨水pH为11
B.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
C.常温下,0.1molL﹣1氯化铵溶液的pH为5
D. 铵盐受热易分解
②下列方法中,可以使氨水电离程度增大的是(填字母序号).
A.加入少量氯化铁固体 B.通入氨气
C.加入少量氯化铵固体 D.加水稀释
(2)盐酸和醋酸是中学常见酸 用0.1molL﹣1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1molL﹣1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线.
①滴定醋酸的曲线是(填“I”或“II”).
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是 .
③V1和V2的关系:V1V2(填“>”、“=”或“<”).
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 .
(3)常温下将0.2mol/L HCl溶液与0.2mol/L氨水溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,求混合溶液中下列算式的精确计算结果(填具体数字): c(H+)﹣c(NH3﹒H2O)=mol/L.
(4)铵盐和氯化银是中学常见盐 ①0.1molL﹣1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较(填溶质的化学式)溶液中NH4+的浓度更大,其原因是
②含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)Ag+(aq)+Cl﹣(aq)
在25℃时,AgCl的Ksp=1.8×10﹣10 . 现将足量AgCl分别放入下列液体中:
①100mL蒸馏水
②100mL 0.3molL﹣1AgNO3溶液
③100mL 0.1molL﹣1 MgCl2溶液
充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为(填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素。如图转化关系中所涉及的物质含有这五种元素的单质或化合物,其中反应①是置换反应,A为金属单质,D为非金属单质,原子核外最外层电子数D是A的2倍,F是一种最高价含氧酸,遇光或热会分解。下列说法正确的是
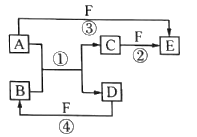
A. 简单氢化物的沸点:Z>W
B. Y与W形成的化合物都可以和氢氧化钠溶液反应
C. Y、Z、W元素中,原子半径最小的是W
D. W与Q组成的常见化合物中可能含有极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、磷及其化合物是非常重要的物质。
(1)Cu+的电子排布式____;
(2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-。[Cu(CN)4]2-的配体为____,[Cu(CN)4]2-中C的杂化方式为____,则1个[Cu(CN)4]2-中含有的σ键的数目为____个;
(3)锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,不溶于水,可通过Na3PO4、CuSO4和NH3·H2O反应制取。制取Cu4O(PO4)2的化学方程式为____;
(4)PCl5中P-Cl键长有198pm和206pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,写出一种阳离子的等电子体的化学式____,PCl5的立体构型为____;
(5)金属铜属于面心立方晶体,铜的密度为ag·cm3,NA表示阿伏伽德罗常数,则铜的配位数____,铜的金属半径为___pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色. 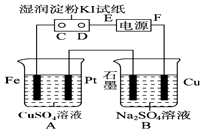
(1)E为电源的极,Fe为极.
(2)A中发生反应的离子方程式为 , B中发生反应的化学方程式为 .
(3)在B中观察到的现象是
(4)若此电源为铅蓄电池,电池总反应式为: Pb+PbO2+4H++2SO42﹣ ![]() PbSO4+2H2O
PbSO4+2H2O
则放电时:正极的电极反应式是;充电时:阴极的电极反应式是;当外电路通过1mol电子时,理论上负极板的质量增加g,此时若要使A池中的溶液复原,应加入g的CuO固体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4燃料电池具有理论电压高、能量密度大等优点。已知,能量密度=电池输出电能/燃料质量,以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
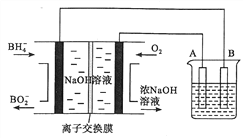
A. 离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B. 该燃料电池的负极反应式为BH4-+8OH--8e-=B![]() +6H2O
+6H2O
C. 若NaBH4 燃料电池的电压为U伏,则此电池的能量密度为2.03×104UkJ·kg-1
D. 每消耗2.24 L O2(标准状况)时,A电极的质量减轻12.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( ) 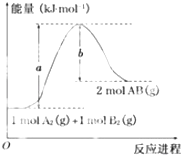
A.每生成2分子AB吸收b kJ热量
B.断裂1mol A﹣A和1mol B﹣B键,放出a kJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热△H=+(a﹣b)kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) =2C(g)+2D(g)在四种不同情况下的反应速率分别为:①v(A)=0.45 mol·L-1·s-1、②v(B)=0.6 mol·L-1·s-1、③v(C)=0.4 mol·L-1·s-1、④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ①>③=②>④ B. ①>②=③>④
C. ②>①=④>③ D. ①>④>②=③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com